EFEITOS PARA A SAÚDE HUMANA DA EXPOSIÇÃO DO MERCÚRIO
É importante fazer uma subdivisão entre exposição crônica e aguda, uma vez que, ambas têm consequências diferentes, assim como a diferença de reação para cada tipo de mercúrio.
Na exposição aguda, a exposição dá-se num curto período de tempo e em elevadas concentrações de substância, já na crônica, as exposições repetem-se durante um período prolongado de tempo (meses, anos ou ao longo da vida) a baixas concentrações, ocorrendo acumulação da substância tóxica no organismo (OPAS/OMS, 2011).
Exposição Aguda
Os efeitos para a saúde provenientes da inalação de elevadas concentrações de mercúrio são inicialmente respiratórios. Estes podem incluir pneumonite, bronquiolite, edema pulmonar e morte (Besser, 2009; Pavlogeorgatos & Vasilis, 2003).
Pode dar origem a efeitos cardiovasculares, gastrointestinais e neurológicos como falta de ar, dor torácica, tosse, náuseas, vômitos e diarreia (Besser, 2009).
Exposição crônica
A exposição durante períodos prolongados pode causar efeitos neuro-comportamentais, incluindo alterações de humor, tremores, ansiedade, distúrbios no sono e depressão (Besser, 2009; Järup, 2003, Pavlogeorgatos & Vasilis, 2003).
Estes sintomas são reversíveis após cessação da exposição (Järup, 2003).
Pode ainda causar hipertensão e disfunções do sistema nervoso autónomo (Järup, 2003; Pavlogeorgatos & Vasilis, 2003).
Existe igualmente a associação com doenças neurodegenerativas, como a doença de Alzheimer ou Parkinson (Cunha, 2008).
Como já mencionado, os efeitos para a saúde que podem resultar da exposição a mercúrio variam na magnitude, dose e duração da exposição. As crianças são mais sensíveis que os adultos, o que resulta numa maior dose deste metal por unidade de peso corporal. Além disso, as crianças desenvolvem variadas atividades no solo onde os valores de vapor de mercúrio são mais elevados (Besser, 2009). A intoxicação por exposição ocupacional ao mercúrio não é necessariamente causada por exposição a quantidades elevadas de mercúrio no ambiente laboral, mas também pode ocorrer com níveis baixos de exposição (Ramírez, 2008), tudo depende das varientes concentração x tempo x tipo de indivíduo e outros fatores.
No geral, os efeitos da exposição de mercúrio para a saúde são:
• Síndromes neurológicas: Constituem o quadro clássico de mercurialismo. Numa primeira fase, é evidenciado por irritabilidade, insônias, sono agitado, medo, debilidade muscular, perda de memória, timidez excessiva, suscetibilidade emocional, hiperexcitabilidade ou depressão produzidas por danos nos centros corticais do sistema nervoso central, que podem levar a encefalite, condicionante do síndroma psico-orgânico crónico e definitivo, que termina na demência da pessoa. São igualmente sinais de danos neurológicos tremores, ataxia, dificuldades na marcha, que são muitas vezes confundidas com a doença de Parkinson. O tremor relaciona-se com a gravidade da intoxicação e com a concentração de mercúrio nos tecidos. Histologicamente, encontra-se degeneração axonal e alterações motoras e sensitivas (Pavlogeorgatos & Vasilis, 2003; Ramírez, 2008).
• Síndromes Renais: Foram descritas lesões glomerulares de vários tipos, desde lesão mínima de aspeto semelhante a nefrose lipoide, até glomerulonefrite proliferativa extracapilar, com proliferação do epitélio da cápsula de Bowman e glomerulonefrite extramembranar. O sistema imunitário é o primeiro a ser afetado, seguido dos danos renais (Ramírez, 2008).
• Síndromes oftalmológicas: Como sinal precoce de intoxicação descrevem-se casos isolados de escotomas anulares e centrais e visão tubular (restrição concêntrica do campo visual). Pode haver nistagmos e cegueira (Pavlogeorgatos & Vasilis, 2003; Ramírez, 2008). Nos exames com lâmpada de fenda, e também como sinal inicial de intoxicação, podem-se encontrar sinais de Atkinson, reflexo acastanhado bilateral e simétrico na cápsula anterior do cristalino, que não afeta a visão. Pode igualmente ocorrer rinite e conjuntivite causadas por ação irritante direta do mercúrio (Ramírez, 2008).
• Síndromes dermatológicas: Dermatite de contacto localizada nas mãos, antebraços ou cara e lesões hiperqueratósicas que podem levar a úlceras; e, em exposição crónica, alopecia reversível (Ramírez, 2008).
EFEITOS TÓXICOS DA EXPOSIÇÃO DO MERCURIO
Os efeitos deste tóxico variam de acordo com a espécie química a que o indivíduo está exposto.
Efeitos provocados pela exposição a Mercúrio Metálico
A inalação é a principal fonte de absorção do mercúrio elementar, sendo rapidamente absorvido pelas membranas alveolares até entrar na circulação sanguínea e difundir-se através da barreira hematoencefálica (OPAS/OMS, 2011). Os distúrbios neurológicos e comportamentais têm sido relatados como os primeiros sinais da intoxicação que incluem: diminuição da memória ou no desempenho de testes de função cognitiva, labilidade emocional, irritabilidade, excitação, timidez excessiva, diminuição da autoconfiança, nervosismo, insónia; alterações neuromusculares (fraqueza, atrofia muscular ou espasmos musculares), tremores, inicialmente afetando as mãos; polineuropatia (parestesia, perda sensorial de extremidades, hiperreflexia, diminuição da velocidade de condução nervosa sensorial e motora) (OPAS/OMS, 2011).
Estudos atuais apoiam que a exposição a vapores de mercúrio induz a um quadro subclínico de danos na visão das cores, inclusive nos locais de trabalho com indicadores de exposição menores que o limite atual(Ramírez, 2008).
Por outro lado, existe uma associação entre o risco de doenças cardiovasculares, onde há uma relação entre concentrações de mercúrio metálico e enfarte do miocárdio (Cunha, 2008). A exposição a esta forma de mercúrio não produz cancro nem teratogenecidade (Ramírez, 2008). Contudo, alguns estudos sugerem que o Hg0 pode causar toxicidade reprodutiva, mas a maioria deles indica que a exposição humana em longo prazo não afeta a capacidade reprodutiva (OPAS/OMS, 2011).
O mercúrio metálico pode causar lesões no fígado que são reversíveis após a cessação da exposição (Järup, 2003). Os danos nos rins são igualmente comuns na exposição a Hg2+ (OPAS/OMS, 2011).
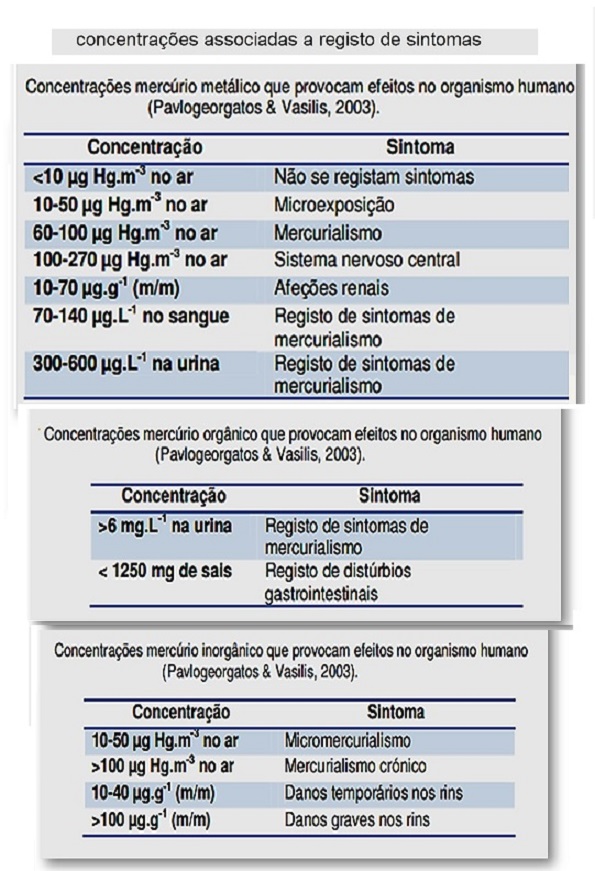
Na tabela acima podemos verificar quais as concentrações associadas a registo de sintomas associados à exposição a esta forma química de mercúrio.
Efeitos provocados pela exposição a Mercúrio Inorgânico
Especificamente o cloreto de mercúrio contido em alguns antissépticos aumenta o colesterol, pelo que, a exposição a este composto pode aumentar o risco ateromatoso em patologia preexistente da aorta (Ramírez, 2008).
A exposição a sais de pode originar acrodinia, reações de hipersensibilidade caracterizadas por descamação, cor rosa na bochechas e planta dos pés e palma das mãos, fotofobia, sudorese, irritabilidade e insónias, sabor metálico, gastroenterite e estomatite (Cunha, 2008; Ramírez, 2008).
O mercúrio inorgânico tem uma menor capacidade de atravessar a barreira placentária sendo encontrado em maior quantidade no líquido amniótico. É igualmente transportado pelo leite materno (Cunha, 2008).
A exposição a esta forma de mercúrio não produz cancro nem teratogenecidade e não está associada a afeções do sistema nervoso central devido à incapacidade de atravessar a barreira hematoencefálica (Järup, 2003; Ramírez, 2008). Na tabela abaixo podemos verificar quais as concentrações associadas a registo de sintomas associados à exposição forma inorgânica do mercúrio.
Efeitos provocados pela exposição a Mercúrio Orgânico
A exposição a esta forma de mercúrio produz cancro e teratogenecidade(aneuploidia, alterações cromossómicas variada, mal formações congénitas, aborto), como aumento da incidência de leucemia; aumento da incidência de cancro do fígado (Pavlogeorgatos & Vasilis, 2003; Ramírez, 2008).
A exposição pré-natal a compostos de mercúrio orgânico leva a defeitos no desenvolvimento cerebral mais intensos à medida que a exposição é mais elevada, onde existem registos de paralisia cerebral severa e microcefalia nos descendentes (Cunha, 2008).
Estão descritos diversos efeitos neurotóxicos relacionados com a exposição a metilmercúrio, nomeadamente ao nível da destreza e coordenação manual e fadiga muscular.
A intoxicação por metilmercúrio caracteriza-se por ataxia (perda de coordenação dos movimentos voluntários), disartria (problemas na articulação das palavras), parestesia (perda da sensibilidade nas extremidades e em torno da boca), visão em túnel (constrição do campo visual) e perda da audição.
Uma contaminação severa pode causar cegueira, coma e morte.
Este metal quando presente numa mulher grávida, é transferido para a placenta e transportado para o feto (Cunha, 2008). O mercúrio pode influenciar o estado hormonal (o eixo hipotálamo-hipofisário), podendo ser responsável por ciclos menstruais irregulares e menor número de ovulações.
Estudos epidemiológicos relacionam os efeitos do mercúrio com problemas reprodutivos (Cunha, 2008).
Na exposição a fenilmercúrio verificam-se os mesmos efeitos que os descritos no caso da exposição a sais de mercúrio inorgânico (Ramírez, 2008).
Na tabela abaixo podemos verificar quais as concentrações associadas a registo de sintomas associados à exposição a esta forma química de mercúrio.
MECANISMOS DE DESINTOXICAÇÃO DO MERCURIO
Aqui também vale comentar que a desintoxicação vai depender da forma do mercurio
Os organismos biológicos possuem diversos mecanismos de resposta a tóxicos.
Os mecanismos de desintoxicação representam uma resposta celular à exposição a tóxicos e pode envolver a conjugação com diversas moléculas.
Outros mecanismos, podem tornar-los menos tóxico ou mais facilmente elimináveis (Aito, 1978; Mattison & Thomford, 1989).
Uma das formas de desintoxicação do mercúrio orgânico é a complexação com o glutationo. Assim, o complexo mercúrio-glutationo é secretado para a bílis, sendo o glutationo o tiol intracelular mais abundante e o maior antioxidante em células humanas (Ballatoni, 2007; Clarkson, Vyas & Carvalho, Chew, Hashemy, Lu & Holmyren, 2008). A estrutura do complexo glutationo com o metal (GS-Hg-SG) é similar ao do glutationo oxidado (GSSG), tendo capacidade para passar a membrana celular dos hepatócitos (Clarkson et al., 2007). Esta reação pode ocorrer espontaneamente ou ser facilitada pela glutationo s-transferase (Casarett & Dolls, 2001). A entrada do mercúrio nas células renais também pode envolver o transporte de membranas de complexos de tiol, nomeadamente com a metionina (Casarett & Dolls, 2001; Clarkson et al., 2007).
INTOXICAÇÃO POR METILMERCURIO
No caso do metilmercúrio, são conhecidos dois mecanismos de desintoxificação. Um, entra na célula formando um complexo com a cisteína e homocisteína através dos transportadores de aminoácidos. No outro, sai da célula complexado com o glutationo nos seus transportadores endógenos (Clarkson et al., 2007).
No primeiro mecanismo, a elevada mobilidade de metilmercúrio no organismo é devida à
formação de complexos de tiol com baixo peso molecular que são transportados através das membranas, à semelhança do que acontece com o mercúrio orgânico. Contudo, a ligação do metilmercúrio aos ligandos de tiol na cisteína resulta num complexo cuja estrutura nas células é a metionina. Como resultado, o complexo metilmercúrio-cisteína entra nas células através dos transportadores de aminoácidos, sendo excretado pelo sistema gastro intestinal (formula mostrada em slaid abaixo abaixo) (Carvalho et al., 2008; Clarkson et al., 2007).
No segundo mecanismo, o metilmercúrio sai das células do fígado para a bílis através de
um complexo com o glutationo nos seus transportadores endógenos. Durante a passagem pela vesicula biliar, o complexo metilHg-GSH é hidrolisado pela gama-glutamiltranspeptidase e enzimas dipeptidases, com o objetivo de libertar os seus aminoácidos constituintes e o metilmercúrio complexado com a cisteína (Clarkson et al., 2007).
O mecanismo de eliminação do mercúrio inorgânico envolve o selénio que é um micronutriente essencial para as funções biológicas e bioquímicas que está relacionado com as selenoproteínas como a glutation peroxidase e tem propriedades antioxidantes únicas (Chen, Hongwei, Zhao, Li, Qu, Liu, Zhang & Chai, 2006; Yoneda & Suzuki, 1996).
Formam se complexos contendo selénio e mercúrio (Hg-Se-selenoproteína P) no plasma e nas células vermelhas do sangue restringindo a toxicidade aguda do mercúrio inorgânico, prevenindo que a sua forma atinja os tecidos alvo.
Em seguida, o complexo é transportado no plasma ligado à albumina e ao atingir o fígado passa a integrar os processos de síntese de selenoproteinas, que são proteínas que contem selénio na forma de selenocesteína ou selenometionina, como o glutationo glutation peroxidase e selenoproteina P.
O excesso de selénio ingerido na dieta seguirá a rota para excreção urinária.
Na presença de mercúrio no plasma, o Se2- formado no eritrócito forma uma forte ligação com este metal e em seguida este complexo liga-se à Selenoproteina P, alterando a distribuição de mercúrio nos órgãos alvos e especialmente reduzindo sua acumulação nos rins (figura 4) (Chen et al., 2006; Gailer, 2002; Yoneda & Suzuki, 1996).
Após a formação do complexo, o selenol é reduzido pelo sistema dependente do glutation e com intervenção das metalotioninas, onde os resíduos de cisteína se ligam ao mercúrio através dos grupos sulfídricos presentes na proteína que é capaz de captar 7, 12 ou 18 átomos de metais dos grupos 11 e 12 da tabela periódica (Chen et al., 2006; Gailer, 2002; Peixoto, 2006; Yoneda & Suzuki, 1996).
FORMAS DE TRATAMENTO
Existem vários elementos protetores dos efeitos do mercúrio no organismo. No caso de intoxicações graves, o tratamento farmacológico depende da espécie química que causa o envenenamento.
Mercúrio metálico A vitamina E é reportada como sendo um agente protetor.
Adicionalmente, o etanol reduz a capacidade de absorção do mercúrio elementar pelo organismo humano, possivelmente pela supressão da atividade da catalase, que o oxida para produzir mercúrio divalente.
O telúrio também parece ter um papel de proteção (Pavlogeorgatos & Vasilis, 2003).
No que diz respeito a tratamentos farmacológicos para o mercurialismo recomenda-se 2,3- dimercaptopropanol-1-sulfunato (DMPS), ácido 2,3-dimercaptosucínico (DMSA), 2,3- dimercaptopropanol (BAL) e D-penicilamina (apesar dos elevados efeitos secundários).
Estes são agentes quelatantes que diminuem a absorção do cloreto de mercúrio (II) no trato gastrointestinal. Têm igualmente uma função protetora do tecido cerebral, impedindo a passagem do HgCl2 pela barreira hematoencefálica.
A biotransformação dá-se no fígado por oxidação do HgCl2 e excreção na urina (Bernhoft, 2012; Ramírez, 2008; Rocha, 2009).
Mercúrio Inorgânico As metalotioninas têm um papel de proteção. Vários compostos quelatantes do mercúrio (como por exemplo o dimercaptopropanol) aceleram a excreção. Finalmente, o selénio parece ter uma ação protetora através da sua ligação ao mercúrio (HgSe) e limita a sua ação aguda no intestino e nos rins conforme detalhado acima. O telúrio tem, também, um papel de proteção (Pavlogeorgatos & Vasilis, 2003).
Mercúrio Orgânico Estudos em animais indicam que o selénio também tem um papel de proteção contra o mercúrio orgânico. É reportado que o N-actil, produto da DL-penicilamina, acelera a excreção, mas o uso de BAL é contraindicado, uma vez que potencia a ação tóxica do mercúrio orgânico (Pavlogeorgatos & Vasilis, 2003; Ramírez, 2008).
No caso de apresentação de insuficiência renal recomenda-se o DMSA e a L-cisteína, complementados com hemodiálise (Ramírez, 2008).
Também a vitamina E reduz a toxicidade e aumenta as hipóteses de sobrevivência após uma exposição a metilmercúrio. Provavelmente o glutationo catalisa a rápida quebra da ligação Hg-C (Pavlogeorgatos & Vasilis, 2003).
MONITORIZAÇÃO BIOLOGICA
Contrariamente à monitorização ambiental, a monitorização biológica permite a avaliação da exposição, a quantidade de substância presentes em órgãos, tecidos e células.
A monitorização biológica torna possível determinar como as concentrações dos químicos nas amostras de material biológico podem estar relacionadas com os efeitos na saúde (Jakubowski, 2012).
Os biomarcadores são fatores bioquímicos (concentrações ou medições de concentrações) mensuráveis no organismo que providenciam informação acerca de três características principais: exposição, suscetibilidade e doença.
Estes são usados como indicadores de eventos ao longo das vias toxicológicas, incluindo a toxicocinética (exposição, dose interna e dose efetiva biológica) e a toxicodinâmica (efeitos biológicos precoces que alteram a estrutura e função e a doença clínica) (Feingold et al., 2010).
A monitorização biológica no estudo de metais pesados pressupõe a análise de matrizes biológicas (sangue, urina, cabelo, unhas, dentes, tecidos e ossos) e tem como vantagens a possibilidade de previsão direta de riscos para a saúde no caso de biomarcadores baseados na saúde (chumbo no sangue, cadmio no sangue e urina, mercúrio e metilmercúrio no sangue, urina e cabelo); a possível avaliação combinada (exposição ocupacional e ambiental) assim como as quantidades acumuladas no organismo; os biomarcadores de efeito podem suportar conclusões no que diz respeito aos possíveis efeitos prematuros para a saúde (Apostoli, 2002; Bartell, 2000; Jakubowski, 2012).
Por vezes os níveis fisiológicos elevados (ex: manganês no sangue), os resultados da determinação de alguns metais nos fluidos biológicos informam apenas acerca do intervalo de exposição interna sem a possibilidade de avaliação do risco para a saúde.
No caso da exposição ocupacional e ambiental ao chumbo, cádmio e mercúrio, a monitorização biológica da exposição pode ser considerada como preferencial à monitorização ambiental, pois torna possível a avaliação direta do risco para a saúde (Jakubowski, 2012).(Temos um capítulo totalmente voltado a intoxicação ocupacionla pelo Hg)
INDICADORES BIOLOGICOS DE EXPOSIÇÃO
Os indicadores biológicos de exposição (IBE) indicam concentrações presentes no organismo, sendo o resultado da interação do químico com as moléculas biológicas das células dos tecidos ou fluidos corporais (Lagadic, Caquet, Amiard & Ramade, 1997).
O marcador biológico de exposição utilizado na pesquisa de mercúrio é o próprio elemento presente nos fluidos biológicos (sangue, urina, leite materno), no cabelo ou ar exalado (Jesus, 2011).
Tendo em conta que o mercúrio é excretado lentamente, o sangue e a urina são os biomarcadores mais amplamente utilizados e os mais influenciados pelas exposições recentes (Bartell, 2000). Contudo, a urina é mais utilizada para exposições crónicas, enquanto o sangue é aplicado para conhecer o grau de exposição recente, uma vez que o tempo de semi vida do mercúrio no sangue é de cerca de 3 dias.
No que diz respeito ao cabelo, este mostra-nos a exposição de longa duração especialmente a metilmercúrio, uma vez que esta espécie química se mantém inalterada. Mas, não é possível afirmar se a concentração existente é de origem endógena ou exógena, pelo que, este biomarcador não deve ser utilizado para avaliação da exposição ocupacional (Jesus, 2011).
Além disso, assume-se que as exposições a este metal ocorrem com regularidade ao longo de um determinado período de tempo, levando a que os marcadores biológicos atinjam concentrações constantes.
Usualmente são comparados os valores dos diferentes marcadores de forma a ser estabelecido um paralelismo.
Assim, assume-se que a concentração de mercúrio no cabelo é cerca de 250 ppm por cada µg.L-1 de sangue. Estas relações são estabelecidas de forma a estimar a concentração que resulta de um determinado tipo de exposição (Bartell, 2000). Existem diversos valores de concentração de mercúrio nos biomarcadores estipulados por diferentes agências mundiais exemplificada em tabela abaixo
INDICADORES BIOLÓGICOS DE EFEITO
Os indicadores biológicos de efeito são registos de alterações periódicas dos efeitos adversos na saúde (Jesus, 2011).
A especificidade destes biomarcadores depende da sua distribuição tecidular no organismo, da natureza e das propriedades do tóxico.
Estes reproduzem parâmetros bioquímicos, alterações histopatológicas e celulares e respostas imunológicas.
Além dos indicadores biológicos de efeito estudados, são exemplos, metalotioninas e metaloproteínas, integridade de DNA, resposta imunitária e compostos
Relação entre o Hg e o stress oxidativo
Os metais induzem toxicidade, apesar de este mecanismo não ser totalmente conhecido (Flora, Mittal & Mehta, 2008; Leslie & koger, 2011).
Os mais importantes são a inibição enzimática e alterações no metabolismo antioxidante (Flora et al., 2008; Leslie & koger, 2011).
Recentemente tem-se dado maior atenção aos efeitos tóxicos do mercúrio no sistema cardiovascular, no que diz respeito à associação com a hipertensão, aterosclerose da carótida, enfarte do miocárdio e doença coronária. No sistema cardiovascular, a exposição aguda ao mercúrio reduz a força do miocárdio e inibe a ação da miosina na contração muscular. Além disso, a exposição crónica a este metal aumenta a resistência vascular e induz hipertensão (Wiggers, Peçanha, Briones, Pérez-Girón, Miguel, Vassalo, Cachofeiro, Alonso & Salaices, 2008).
Existem igualmente evidências de que os metais pesados estão associados a diversas doenças neurológicas como o Parkinson, Alzheimer, esquizofrenia, esclerose lateral amiotrófica e síndrome de Dawn (Aschner, Syversen, Souza, Rocha, Farina, 2007; Leslie & koger, 2011).
O stress oxidativo também tem um papel importante noutras condições patológicas como doenças autoimunes e inflamatórias (artrite reumatoide e isquémica), cancro e diabetes (Aschner et al., 2007).
Os metais são capazes de interagir com proteínas nucleares, DNA, causar peroxidação lipídica e redução dos grupos tiol das proteínas, causando a deterioração oxidativa de macromoléculas biológicas (Alissa & Ferns, 2011; Flora et al., 2008).
O stress oxidativo resulta do excesso de espécies reativas de oxigénio (ROS) e de azoto (RNS), cuja geração pode ser catalisada, sobretudo, por ferro, cobre, cádmio, mercúrio, níquel, chumbo e arsénio. Contêm átomos de oxigénio ou azoto, podem ser radicais livres e causar a diminuição da atividade antioxidante devido à oxidação de diversos compostos químicos no organismo (Flora et al., 2008; Leslie & koger, 2011).
Apesar de não se conhecer exatamente o mecanismo exato de geração de radicais livres, tem sido colocada a hipótese que a diminuição do glutation reduzido (GSH), por ação do mercúrio, pode não impedir a proliferação de ROS (Wiggers et al., 2008). Para este mecanismo contribuem igualmente radicais de carbono, enxofre e azoto, que originam não só radicais superóxido, mas radicais de aminoácidos, de péptidos e proteínas complexadas com metais tóxicos (Flora et al., 2008). Desta forma, a consequência resulta em danos ou morte celular, causando neurotoxicidade, hepatotoxicidade e nefrotoxicidade em animais e humanos (Flora et al., 2008; Leslie & Koger, 2011).
O desequilíbrio redox induzido pelo mercúrio pode ser causado pelo aumento da produção de ROS e RNS ou pela diminuição da capacidade defensiva dos antioxidantes. Desta forma, o mercúrio pode ligar-se e formar complexos com os compostos que contêm tiol, tornando as proteínas num alvo. Mais, a sua elevada afinidade por estes grupos e a sua capacidade de ligação ao selénio para formar complexos insolúveis reduzem as defesas oxidativas e promovem o stress por radicais livres e peroxidação lipídica. Está demonstrado que este metal altera a integridade estrutural da membrana interna das mitocôndrias, resultando na perda da seletividade no transporte de cations. Outro mecanismo possível, através do qual o mercúrio pode promover a peroxidação lipídica e a subsequente aterosclerose é a inibição da ativação do complexo proteico com funções de transcrição, o fator nuclear kB (NF-kB).
Também está descrito que o mercúrio suprime a produção de um radical livre, o óxido nítrico (NO) através da inibição do metabolismo do NF-kB.
Existem evidências que o mercúrio pode induzir a alterações na agregação plaquetária pela ligação aos grupos tiol presentes nas membranas das plaquetas (Alissa & Ferns, 2011).
A integridade funcional do endotélio é crucial para a manutenção da corrente sanguínea e da capacidade antitrombótica porque o endotélio liberta fatores humorais, responsáveis por mecanismos de inflamação e que controlam o relaxamento e a contração, a trombogénese e a ativação ou inibição das plaquetas. O endotélio vascular é altamente sensível ao stress oxidativo, e este é a principal causa da disfunção endotelial observada nas doenças cardiovasculares como a hipertensão e aterosclerose. É bem conhecido que, por interação do NO, o radical anion superóxido (O2 – ) forma peroxinitrito (NO3 – ), diminuindo a disponibilidade de NO para o relaxamento muscular do músculo liso (Wiggers et al., 2008).
Relação entre o Mercúrio e a Paraoxonase Humana
A paraoxonase-1 (PON-1, E.C. 3.1.8.1) é uma proteína hidrossolúvel glicosilada, uma vez que se une a lípidos e outras moléculas orgânicas, com 355 resíduos de aminoácidos, com massa molar de 43-47 kDa, contendo três cadeias de glícidos que correspondem a 15,8% do seu peso. Tem como função fisiológica o metabolismo de lípidos oxidados na LDL e HDL, além da hidrólise de organofosfatos, ésteres aromáticos, algumas lactonas aromáticas e alifáticas e catalisa a reação inversa de ácidos γ- e δ- hidroxicarboxílicos. É sintetizada pelo fígado e secretada no sangue, onde circula com associação com as lipoproteínas de alta densidade (HDL), prevenindo a formação de LDL oxidada por inativação de fosfolípidos oxidados (figura 17) (Ferreira, 2007; Veiga et al., 2011). Os peróxidos lipídicos inibe a paraoxonase, arilesterase e as atividades antioxidantes da PON1 através de interações com o grupo tiol do enzima. A consequência é a oxidação da HDL acompanhada da diminuição da atividade da paraoxonase e, consequentemente, da redução da sua capacidade de proteção contra a oxidação da LDL (Tomás, Latorre, Sentí & Murrugat, 2004).
Derivado da conhecida capacidade dos metais tóxicos na inibição enzimática, experiências in vitro levaram à pesquisa dos efeitos inibitórios dos metais tóxicos na atividade da PON-1. Foi reportado que o cobre e compostos de mercúrio são potentes inibidores da atividade deste enzima nos microssomas do fígado humano (Ayotte et al., 2011; Hernández et al. 2009). Esta localização particular pode representar uma resposta seletiva das lipoproteínas celulares ao stress oxidativo, uma vez que a PON-1 perde atividade sob estas condições, o que leva a crer que este enzima tem um papel como antioxidante. Assim, a PON-1 pode estar relacionada com funções de defesa contra os efeitos adversos de tóxicos ambientais com potencial impacto na saúde pública e ocupacional (Hernández et al. 2009). A inibição da atividade da PON-1 está, muito provavelmente relacionada, com a ligação dos metais a grupos tiol livres do enzima localizados no resíduo Cys 284, que é essencial na proteção da oxidação da LDL. Existem estudos em trabalhadores com exposição de longa duração a chumbo que exibiram um decréscimo na atividade da PON-1, o que sugere que este metal, assim como outros iões de metais divalentes, após ligação com grupos tiol livres da PON-1 reduzem, não só a sua atividade hidrolítica, como também a sua função antioxidante. Contudo, o stress oxidativo induzido pelos metais pode igualmente ser um mecanismo para a inativação da PON-1 (Hernández et al. 2009). Desta forma, o estudo da associação entre a exposição ocupacional ao mercúrio e a atividade deste enzima, pode ser de extrema relevância para a saúde ocupacional.
Relação entre o Mercúrio e a Vitamina A
A vitamina A pertence ao grupo das vitaminas lipossolúveis, sendo um micronutriente essencial que existe nas formas de álcool (retinol), aldeído (retinal), ácido carboxílico (ácido retinóico) e ésteres (palmitato de retinol) (Sauer, 2006). Contém um anel β-ionona e uma cadeia de hidrocarbonetos, com saturações alternadas, ligadas a um grupo funcional . Desempenha inúmeras funções vitais no organismo desde a fase neonatal até à fase adulta, de onde se podem destacar funções na proliferação e diferenciação celular, no desenvolvimento embrionário, na regulação do mecanismo da visão e na imunidade (Rosa, 2009). Esta vitamina tem despertado interesse na comunidade científica pela sua capacidade de proteção contra doenças cardiovasculares, cancro, cataratas, deficiências imunitárias e envelhecimento (Sauer, 2006). Atua nas diversas membranas celulares, devido à sua função química como agente antioxidante (Sauer, 2006; Szlayatys-Sidorkiewicz, Zaguierski, Jankowska, Luczak, Macur, Baczek, Korzon, Krzykowskig, Martysiak-Zurowska & Kaminska, 2012). O seu potencial antioxidante tem sido associado à sua capacidade de interagir com os ROS através da transferência de eletrons e remoção de ions de hidrogénio (Rosa, 2009). Desta forma, pode ser considerada como um antioxidante que quebra as ligações efetivas no início da peroxidação lipídica, travando a reação em cadeia de proliferação de ROS por sequestro de radicais livres (Alpsoy, Yildirim & Agar, 2009). Assim, considera-se que a vitamina A protege os organismos contra os tóxicos efeitos dos químicos ambientais, onde se encontra incluída a exposição a mercúrio por via ocupacional, e mesmo crônica tendo em conta que diversos estudos mostram que os efeitos tóxicos dos metais nas células podem ser minimizados por esta vitamina (Alpsoy et al., 2009; Sauer, 2006). Contudo, a utilização de vitaminas como antioxidante vai originar a sua indisponibilidade para as suas funções vitais no organismo, originando os mesmos efeitos que uma avitaminose, que pode provocar o bloqueio de uma ou mais reações metabólicas e um distúrbio no balanço metabólico do organismo (Sauer, 2006).
Relação entre o Mercúrio e a Vitamina E
Cada antioxidante tem importantes e diferentes mecanismos de ação, uma vez que o dano oxidativo pode ser causado por moléculas solúveis em lípidos ou água (Cebi, Kaya, Gungor, Demir, Yoruk, Soylemez,Gunes & Tuncer, 2011). Na natureza, a vitamina E compreende oito compostos naturais lipossolúveis (α-, β-, γ- e δtocoferol) e quatro tocotrienois (α-, β-, γ- e δ-tocotrienol) (Al-Attar, 2011). É um componente essencial na dieta humana e é um poderoso antioxidante lipossolúvel com capacidade para sequestrar os radicais livres, prevenir a peroxidação lipídica e estabilizar a membrana celular, por doação de hidrogénio fenólico e eletrões (Abd El-Aziz, El-Fark & Saleh, 2012; Alpsoy et al., 2009; Rosa, 2009). Esta vitamina também tem funções anticarcinogénicas, anticlastogénicas, antimutagénicas em determinados organitos subcelulares (Agarwal, Goel, Chandra & Behari, 2010; Durak, Uzun, Kalender, Ogutu, Uzunhisarcikl & Kalender, 2009). Os antioxidantes solúveis em lípidos são muito importantes na prevenção da peroxidação da LDL, e esta ação pode ser de extrema importância na prevenção da aterosclerose, uma vez que as moléculas lipossolúveis como a vitamina E e o β-caroteno são incorporados nas partículas de LDL. Desta forma, a vitamina E tem um papel essencial na proteção contra os danos provocados pelos radicais livres, e consequentemente na redução do risco de doenças cardiovasculares (Cebi et al., 2011). Tem igualmente um poder protetor contra a toxicidade provocada pelo mercúrio, inibindo os danos oxidativos provocados no fígado e em outros tecidos (Agarwal et al., 2010; Jin, Hidiroglou, Lok, Taylor, Kapal, Ross, Sarafin, Lau, De Souza, Chan & Mehta, 2012). Com o aumento da preocupação, inclusive por parte da Organização Mundial de Saúde, com a da exposição ocupacional a químicos tóxicos e devido aos problemas de saúde induzidos pela exposição ocupacional ao mercúrio, o estudo da influência da vitamina E no poder antioxidante deste metal tem um interesse considerável, nomeadamente ao nível da saúde cardiovascular (Abd El-Aziz et al., 2012; Beyrouty & Chan, 2006; Jin et al., 2012).
Medicina Complementar na desintoxicação por Mercurio
Nutrir-se e não apenas alimentar-se…
Na Nutrição Antroposófica fica clara a diferença entre alimentar-se e nutrir-se. A alimentação consiste, apenas, em uma escolha de alimentos ou matérias diversas e na ingestão dos mesmos enquanto a nutrição é o processo de nutrir o organismo, não somente com calorias, macronutrientes e micronutrientes onde todo o nosso ser está envolvido em cada ingestão de alimento: pensamento, sentimento, vontade, consciência e inconsciência, corpo, alma e, principalmente, a funcionalidade do que se está ingerindo
Não comemos para ter em nós determinadas substâncias corpóreas, mas sim para termos as forças que podemos humanizar e manter nossas células com energia. Um alimento não é constituído apenas de elementos químicos materiais, mas de algo vivo, dinâmico e interage com todo o universo que participa de sua criação”
A alimentação é um das mais potentes ferramentas para a desintoxicação e, consequentemente, para a Qualidade de Vida
Algumas sugestões:
Vitamina A, Vitamina E, Chlorella, alho, cavalinha, suco de groselha roxa ou negra (orgânica), suco de toranja, castanha do Pará (riquíssima em selênio) e outras bebidas e shakes naturais.
continua…