Imunologia: a via de sinalização inflamatória contribui para detecção de muitas doenças, mas é fundamental entender esse processo.
Temos nos deparado com inúmeras opiniões e informações de profissionais renomados e estamos buscando as realidades dessas informações bioquímicas para compreendermos e relacionarmos a cadeia “imuno-fisio-bioquímica”.
Na realidade, nem sabemos se são opiniões dessas pessoas ou os ditos FAKES por isso alertamos. PARA QUALQUER INFORMAÇÃO, CONHEÇA A FONTE.
Nosso grupo está fazendo uma série de estudos com algumas vitaminas, coenzimas, plantas herbáceas, proteínas de rápida absorção, etc e resolvemos trazer este artigo antecipadamente apenas para ajudar a elucidar uma questão pautada sobre INFLAMAÇÃO X VACINA X REDUÇÃO DE ATEROMA (reduzindo INFARTO, AVC, etc). Esse tema é de nosso extremo interesse e, daí, estarmos buscando trazer mais informações para nosso conhecimento.
É EXTREMAMENTE IMPORTANTE ESCLARECER O QUE É INFLAMAÇÃO, O QUE É INFEÇÃO E QUAIS OS MECANISMOS E MODERADORES EXISTENTES – esse é outro tema que explicamos detalhadamente em outros artigos…
Nossa finalidade nesses estudos científicos e nessas pesquisas é trazermos conclusões científicas reais para a melhoria da nossa qualidade de vida.
Nosso grupo complementa uma frase de nosso mestre Hipocrates dizendo:
“Que seu alimento seja seu remédio, não o seu veneno…”
Um de nossos estudos e pesquisas está na Coenzima Q10
A Coenzima Q10 está presente em praticamente todas as células do organismo. No entanto, por sua participação na produção de ATP, ela é mais concentrada em órgãos de grande demanda energética. Entre eles estão o coração, o cérebro, os rins e o fígado.
A Coenzima Q10 também é considerada um potente antioxidante intracelular protegendo a estrutura das células da destruição da própria parede celular causada pelos radicais livres produzidos diariamente pelo metabolismo energético. A Coenzima Q10 estimula a biogênese mitocondrial – ou seja, a produção de novas mitocôndrias dentro das células.
A sua maior ação contra os radicais livres se dá pois a Coenzima Q10 potencializa a atividade do complexo proteico NF-kB, que está envolvido na resposta celular a estímulos como o estresse, radicais livres, radiação ultravioleta, oxidação de LDL e antígenos virais e bacterianos. O NF-κB também desempenha um papel fundamental na regulação da resposta imunitária à infecção.
A Coenzima Q10 é encontrada no organismo em duas formas diferentes: ubiquinona e ubiquinol. De uma forma simples: a ubiquinona é necessária na produção de energia sob a forma de ATP, e o ubiquinol tem uma ação antioxidante pelo complexo NF-kB.
Portanto, vamos falar aqui na parte anti oxidante ou seja, no complexo NF-kB
O Sistema imunológico assim como todos os fatores que se relacionam a esse sistema tem um funcionamento claro
Sabemos que várias doenças são decorrentes de processos inflamatórios que geramos de forma direta ou indireta em nosso organismo e trazemos este artigo científico para levar um pouquinho de conhecimento desses processos para aqueles que não conhecem a fim de medir e remedir suas suposições e dar fundamentos e subsídios técnicos para essas “opiniões”.
Trouxemos um dos artigos mais interessantes sobre Imunologia – inflamação e função do NF-kB
Espero que colegas farmacêuticos e médicos leiam e relembrem esses mecanismos, opinem de forma técnica e contribuam de forma científica para informação de todos.
Deixamos as referências bibliográficas citadas para leitura e comentários técnicos fundamentados.
Essa é a nossa obrigação
Dra. Célia Wada
Imunologia: a via de sinalização inflamatória contribui para detecção de muitas doenças
Visar uma via de sinalização crítica envolvida na imunidade inata e adaptativa pode ajudar a tratar uma série de doenças inflamatórias. Em um artigo de revisão, Shao-Cong Sun e colegas do MD Anderson Cancer Center da Universidade do Texas, em Houston, EUA, discutem como a família de fatores de transcrição que compõem a via do fator nuclear κB (NF-κB) medeia a expressão de muitos genes implicados em diferentes processos das respostas imunes e inflamatórias do corpo. Os autores primeiro descrevem a função do NF-κB em diferentes tipos de células imunes. Eles então detalham como a sinalização de NF-κB dá errado em várias doenças inflamatórias, incluindo artrite reumatóide, esclerose múltipla e doença inflamatória intestinal. Drogas que bloqueiam diferentes etapas da via NF-κB podem ajudar a tratar essas doenças,
Signal Transduction and Target Therapy
Sinalização de NF-κB na inflamação
Ting Liu , Lingyun Zhang , Donghyun Joo & Shao-Cong Sun
ARTIGO – Transdução de sinal e terapia direcionada, volume 2 , número do artigo: 17023 ( 2017 )
O fator de transcrição NF-κB regula vários aspectos das funções imunes inatas e adaptativas e serve como mediador central das respostas inflamatórias. O NF-κB induz a expressão de vários genes pró-inflamatórios, incluindo aqueles que codificam citocinas e quimiocinas, e também participa da regulação do inflamassoma. Além disso, o NF-κB desempenha um papel crítico na regulação da sobrevivência, ativação e diferenciação de células imunes inatas e células T inflamatórias. Consequentemente, a ativação desregulada de NF-κB contribui para os processos patogênicos de várias doenças inflamatórias. Nesta revisão, discutiremos a ativação e função do NF-κB em associação com doenças inflamatórias e destacaremos o desenvolvimento de estratégias terapêuticas baseadas na inibição do NF-κB.
O fator nuclear κB (NF-κB) representa uma família de fatores de transcrição induzíveis, que regula uma grande variedade de genes envolvidos em diferentes processos das respostas imune e inflamatória. 1 Essa família é composta por cinco membros estruturalmente relacionados, incluindo NF-κB1 (também chamado de p50), NF-κB2 (também chamado de p52), RelA (também chamado de p65), RelA (também chamado de p65), RelB e c-Rel, que medeia a transcrição de genes-alvo por ligação a um elemento específico de DNA, potenciador de kB, como vários hetero ou homo-dímeros. 2 As proteínas NF-κB são normalmente seqüestradas no citoplasma por uma família de proteínas inibidoras, incluindo membros da família IκB e proteínas relacionadas, caracterizadas pela presença de repetições de anquirinas. 3Até o momento, o membro da família IκB mais estudado e mais importante é o IκBα. Além disso, as proteínas precursoras de NF-κB1 e NF-κB2, p105 e p100, servem como proteínas do tipo IκB, porque sua poção C-terminal se assemelha à estrutura de IκB e possui funções inibidoras de NF-κB. 4
A ativação do NF-κB envolve duas principais vias de sinalização, as vias canônica e não-canônica (ou alternativa), ambas importantes para a regulação das respostas imunes e inflamatórias, apesar de suas diferenças no mecanismo de sinalização. 3 , 5 A via canônica de NF-κB responde a diversos estímulos, incluindo ligantes de vários receptores de citocinas, receptores de reconhecimento de padrões (PRRs), membros da superfamília do receptor de TNF (TNFR), bem como receptores de células T (TCR) e B- receptor celular. 6 O mecanismo primário para a ativação canônica de NF-κB é a degradação induzível de IκBα desencadeada por sua fosforilação específica do local por um complexo de subunidade IκB cinase (IKK). 1 , 7O IKK é composto por duas subunidades catalíticas, IKKα e IKKβ, e uma subunidade reguladora denominada modulador essencial NF-κB (NEMO) ou IKKγ. 8 A IKK pode ser ativada por diferentes estímulos, incluindo citocinas, fatores de crescimento, mitógenos, componentes microbianos e agentes estressores. 9 Após a ativação, a IKK fosforila IκBα em duas serinas N-terminais e, assim, desencadeia a degradação de IκBα dependente de ubiquitina no proteassoma, resultando em translocação nuclear rápida e transitória de membros canônicos de NF-κB predominantemente os p50 / RelA e p50 / c- Dímeros Rel. 4 , 7 , 10
Em contraste com a via canônica de NF-κB, a via não canônica de NF-κB responde seletivamente a um grupo específico de estímulos, incluindo ligantes de um subconjunto de membros da superfamília TNFR, como LTβR, BAFFR, CD40 e RANK. 11 , 12 Além disso, a ativação não canônica de NF-κB não envolve degradação de IκBα, mas depende do processamento da proteína precursora de NF-κB2, p100. 3 , 11 Uma molécula central de sinalização para essa via é a quinase indutora de NF-κB (NIK), que ativa e coopera funcionalmente com a IKKα para mediar a fosforilação da p100, que por sua vez induz a ubiquitinação e o processamento da p100. 13 , 14O processamento de p100 envolve a degradação de sua estrutura do tipo C-terminal IκB, resultando na geração de NF-κB2 p52 maduro e na translocação nuclear do complexo não-canônico de NF-κB p52 / RelB. 3 , 6 , 11 Funcionalmente, o NF-κB canônico está envolvido em quase todos os aspectos das respostas imunes, enquanto a via não-canônica de NF-κB parece evoluir como um eixo de sinalização complementar que coopera com a via canônica de NF-κB na regulação de funções do sistema imunológico adaptativo. 12
Uma função bem reconhecida do NF-κB é a regulação das respostas inflamatórias. Além de mediar a indução de vários genes pró-inflamatórios nas células imunes inatas, o NF-κB regula a ativação, diferenciação e função efetora das células T inflamatórias. 15 , 16 Evidências recentes sugerem que o NF-κB também tem um papel na regulação da ativação de inflamassomas. 17 Não é de surpreender que a ativação desregulada de NF-κB seja uma marca registrada de doenças inflamatórias crônicas. Portanto, uma melhor compreensão do mecanismo subjacente à ativação de NF-κB e à função pró-inflamatória é de grande importância para estratégias terapêuticas no tratamento de doenças inflamatórias.
NF-κB como mediador da indução de genes pró-inflamatórios
A inflamação é uma resposta protetora do hospedeiro a infecções e danos nos tecidos, caracterizada por uma série de reações, incluindo vasodilatação e recrutamento de células imunes e proteínas plasmáticas para o local da infecção ou lesão tecidual. 6 , 15 Normalmente, a inflamação é benéfica para o hospedeiro e pode ser resolvida em tempo hábil; no entanto, respostas inflamatórias desreguladas podem causar danos teciduais excessivos ou duradouros, contribuindo para o desenvolvimento de doenças inflamatórias agudas ou crônicas. O NF-κB é um mediador central da indução de genes pró-inflamatórios e funciona em células imunes inatas e adaptativas.
Função do NF-κB em células imunes inatas
As células imunes inatas, incluindo macrófagos, células dendríticas e neutrófilos, são importantes atores da imunidade e inflamação inatas. Essas células expressam PRRs que detectam vários componentes microbianos, os chamados padrões moleculares associados a patógenos (PAMPs). 18 , 19 Os PRRs também reconhecem padrões moleculares associados a danos (DAMPs), que são moléculas liberadas por células necróticas e tecidos danificados. As células de mamíferos expressam cinco famílias de PRRs, incluindo receptores toll-like (TLRs), receptores tipo RIG-I, receptores tipo NOD (NLRs), receptores tipo lectina tipo C e sensores de DNA citosólico. 18 , 20 , 21As diferentes famílias de PRRs possuem propriedades estruturais distintas e respondem a diferentes PAMPs e DAMPs, mas compartilham muitas semelhanças nas vias de transdução de sinal a jusante.
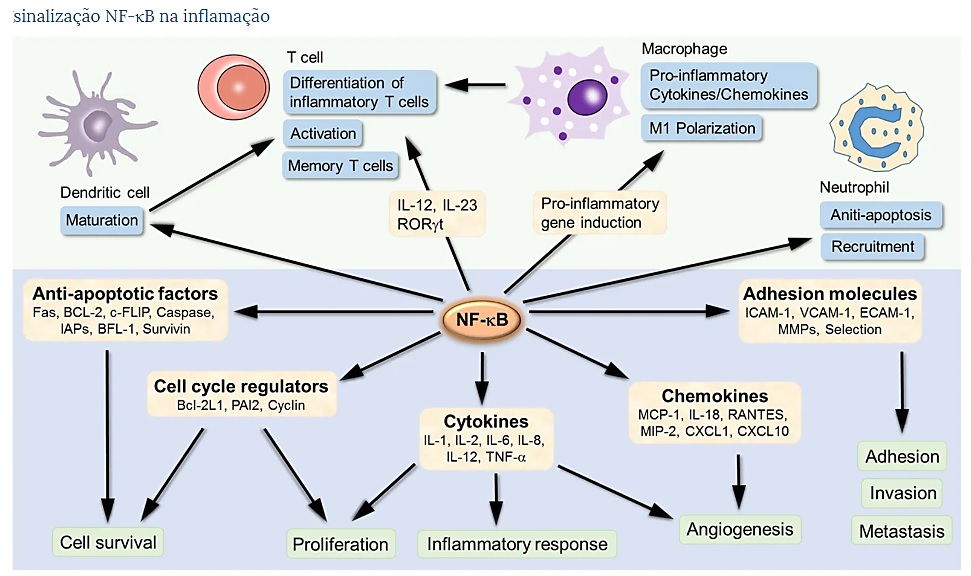
Um evento de sinalização comum dos PRRs é a ativação da via canônica de NF-κB, responsável pela indução transcricional de citocinas pró-inflamatórias, quimiocinas e mediadores inflamatórios adicionais em diferentes tipos de células imunes inatas ( Figura 1 ). 2 , 22 , 23 Esses mediadores inflamatórios podem se envolver diretamente na indução da inflamação e atuar indiretamente, promovendo a diferenciação das células T inflamatórias. Um componente de sinalização que integra as diferentes vias de PRR para a ativação de NF-κB está transformando a quinase 1 ativada pelo fator de crescimento β (TAK1). 24 – 26A TAK1 possui duas subunidades reguladoras, TAB1 e TAB2, a última capaz de se ligar a cadeias de poli-ubiquitina, necessárias para a ativação da TAK1. Após a ativação, TAK1 ativa a quinase IKK a jusante, mediando assim a fosforilação de IκBα e a ativação de NF-κB. 27
Os genes alvo de NF-κB envolvidos no desenvolvimento e progressão da inflamação. NF-κB é um fator de transcrição induzível. Após sua ativação, ele pode ativar a transcrição de vários genes e, assim, regular a inflamação. O NF-κB tem como alvo a inflamação não apenas diretamente aumentando a produção de citocinas inflamatórias, quimiocinas e moléculas de adesão, mas também regulando a proliferação celular, apoptose, morfogênese e diferenciação.
A função pró-inflamatória do NF-κB tem sido extensivamente estudada em macrófagos, uma grande família de células imunes inatas que residem em diferentes tecidos e funcionam na linha de frente de uma resposta imune contra infecções. 28
Em resposta a diversos PAMPs e DAMPs, os macrófagos tornam-se rapidamente ativados e secretam uma grande variedade de citocinas e quimiocinas. Sob diferentes condições fisiopatológicas, os macrófagos ativados são capazes de diferenciar-se em estados fenotipicamente diferentes, incluindo os macrófagos classicamente ativados (M1) e ativados alternativamente (M2). 29 , 30
Os macrófagos M1 são caracterizados pela produção de citocinas pró-inflamatórias, como IL-1, IL-6, IL-12, TNF-α e quimiocinas, envolvidas em vários processos inflamatórios. Os macrófagos M1 também promovem a diferenciação de células T inflamatórias, incluindo as células Th1 e Th17, que por sua vez mediam a inflamação. 30 , 31 Por outro lado, os macrófagos M2 produzem citocinas anti-inflamatórias, como IL-10 e IL-13, e são importantes na resolução da inflamação e na mediação da cicatrização de feridas. 32 Os sinais TLR têm um papel importante na regulação da polarização de macrófagos. 30 Em particular, o lipopolissacarídeo do ligando TLR4 (LPS) promove a diferenciação de macrófagos em relação ao fenótipo M1. 24O LPS estimula a sinalização de macrófagos através de dois adaptadores TLR diferentes, MyD88 e TRIF. 24 Evidências genéticas sugerem que a via TLR dependente de MyD88 é crucial para a polarização de macrófagos M1 e expressão induzível de citocinas pró-inflamatórias. 33 A sinalização TLR dependente de MyD88 envolve a ativação da família IRAK de cinases, que por sua vez estimulam a atividade da u3-ubiquitina ligase do TRAF6, permitindo que o TRAF6 sofra uma auto-ubiquitinação e conjugue cadeias de ubiquitina a outras moléculas de sinalização envolvidas na ativação de uma quinase dependente de ubiquitina, TAK1. 24 , 25Após a ativação, TAK1 ativa a quinase IKK a jusante, que por sua vez fosforila o inibidor de NF-κB IκBα, levando à degradação de IκBα dependente de ubiquitina e ativação de NF-κB. 27 O NF-κB é um fator-chave de transcrição dos macrófagos M1 e é necessário para a indução de um grande número de genes inflamatórios, incluindo aqueles que codificam TNF-α, IL-1β, IL-6, IL-12p40 e ciclooxigenase-2. 30
Uma função principal da via de sinalização TLR dependente de TRIF é mediar a indução de IFNs do tipo I e genes indutíveis por IFN. 34 Essa via envolve o recrutamento de proteínas TRAF, particularmente TRAF3, para TRIF e a subsequente ativação da quinase de ligação a TANK 1 (TBK1) e IKKɛ em um mecanismo que se pensa envolver a ubiquitinação por TRAF3 e o recrutamento de TBK1 e IKKɛ dependente de ubiquitina. 34 , 35 O TBK1 e o IKKK ativados fosforilam o fator de transcrição IRF3 e, assim, induzem a dimerização do IRF3, levando à indução transcricional de IFNs do tipo I, IFN-α e IFN-β. 30 , 34
Além da ativação do IRF3, a via TLR dependente do TRIF ativa o NF-κB através da estimulação da proteína 1 que interage com o receptor do adaptador quinase (RIP1). 19 , 24 Esta última função da sinalização do TRIF envolve a ativação de uma ligase de ubiquitina E3, Peli1, que conjuga cadeias de ubiquitina ligadas à lisina 63 ao RIP1, facilitando assim o recrutamento e a ativação da IKK. 36 Como observado na via MyD88, o NF-κB estimulado por TRIF medeia a indução de genes de citocinas inflamatórias.
Portanto, NF-κB é um mediador crítico das respostas inflamatórias de macrófagos desencadeadas pelas vias dependentes de MyD88 e TRIF. Além disso, o NF-κB também medeia as funções de sinalização pró-inflamatória de vários outros PRRs.
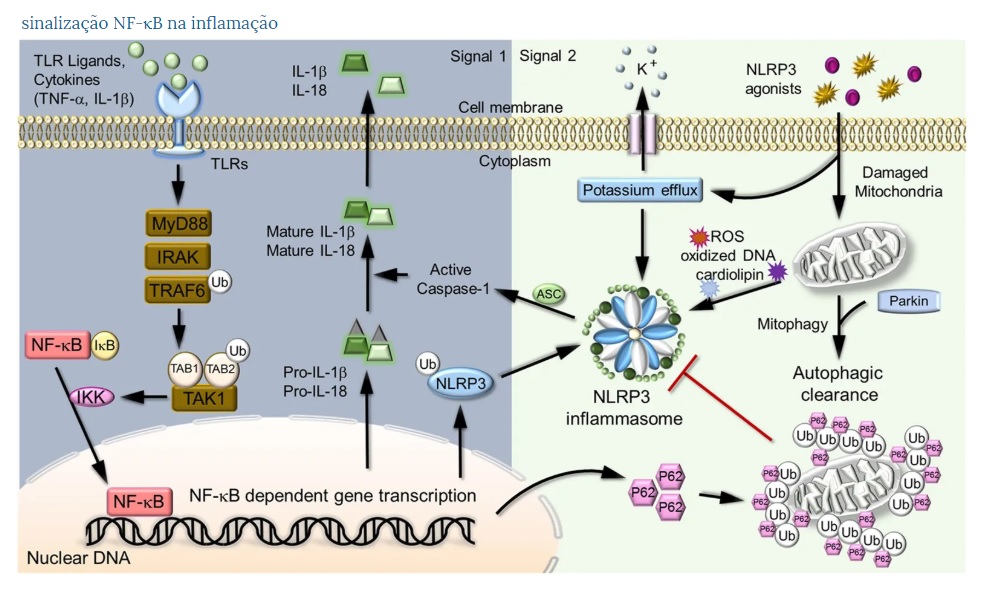
NF-κB na regulação do inflamassoma NLRP3. A ativação do inflamassoma NLRP3 requer dois sinais, priming e ativação. Um exemplo prototípico de iniciação é a ligação bacteriana do LPS ao TLR4, levando à ativação da sinalização de NF-κB. No núcleo, o NF-κB ativo promove a transcrição de genes dependentes de NF-κB, como NLRP3, Pro-IL-1β e Pro-IL-18, necessários para a ativação do inflamassoma. O segundo sinal de ativação do inflamassoma é fornecido pelos agonistas do NLRP3 que ativam o NLRP3 para desencadear a montagem do inflamassoma e secreção madura de IL-1β. Até o momento, o dano mitocondrial é o estímulo ativador mais amplamente estudado para a via NLRP3 em termos de sua conexão com diversas doenças inflamatórias, metabólicas e malignas. NF-κB induz acúmulo tardio do receptor de autofagia p62
Atualmente, o inflamassoma NLRP3 é o inflamassoma mais amplamente estudado, composto por NLRP3, ASC e pró-caspase 1, além de uma proteína reguladora essencial, a quinase 7 relacionada ao NIMA (NEK7).
A ativação do inflamassoma NLRP3 geralmente requer um sinal de iniciação (sinal 1) e um sinal de ativação (sinal 2).
Um papel principal do sinal de iniciação é induzir a expressão transcricional de NLRP3 e pró-IL, uma vez que a maioria dos tipos de células possui níveis insuficientes de NLRP3 para ativação do inflamassoma e não expressam constitutivamente pro-IL-1β. 60 , 61 Além disso, evidências emergentes sugerem que o sinal 1 também pode iniciar o NLRP3 por meio de mecanismos pós-traducionais, como a desubiquitinação do NLRP3. 62 , 63
Os indutores típicos do sinal 1 incluem componentes microbianos, como ligantes de TLR e citocinas como TNF-α e IL-1β, que são conhecidas por ativar o NF-κB, um ativador transcricional dos genes NLRP3 e pro-IL-1β . O segundo sinal de ativação do inflamassoma é acionado por vários PAMPs e DAMPs, como toxinas formadoras de poros, RNAs virais, ATP e substâncias cristalinas. 60 , 64
Pensa-se que esses diversos estímulos ativem a NLRP3 por indução de diferentes eventos celulares, incluindo efluxo de K + , sinalização de Ca2 + , danos mitocondriais e lisossômicos que liberam substâncias como espécies reativas de oxigênio, DNA mitocondrial oxidado e proteases lisossômicas. 61
NF-κB é um mediador central do sinal de iniciação da ativação do inflamassoma NLRP3 e atua induzindo a expressão transcricional de NLRP3 e pro-IL-1β em resposta a vários ligantes e citocinas de PRR. 3 , 17
Como o gene pro-IL-1β , o gene NLRP3 é um alvo direto de NF-κB e contém locais de ligação a NF-κB em sua região promotora. 65
Assim, a incubação de macrófagos estimulados por LPS com um inibidor da IKK, Bay11-7082, bloqueia a indução de NLRP3 e a ativação da caspase 1 por ATP. 57 , 66
No entanto, o papel da via de sinalização de NF-κB na regulação do inflamassoma parece ser complexo, uma vez que os macrófagos com deficiência de IKKβ exibem hiperativação da caspase 1 e secreção aprimorada de IL-1β na estimulação do LPS, e os camundongos knockout para as células mielóides IKKβ são mais sensível ao choque da endotoxina. 67 O papel negativo da IKKβ na ativação do inflamassoma parece envolver a indução da autofagia, um sistema de degradação intracelular que mantém a homeostase celular através da degradação de proteínas anormais e organelas danificadas como mitocôndrias. 68Estudos anteriores sugerem que a IKK é importante para a indução da autofagia, que por sua vez regula negativamente a ativação do inflamassoma, mantendo as mitocôndrias saudáveis para impedir a liberação do DNA mitocondrial das espécies reativas de oxigênio e possivelmente também degradando os principais componentes do complexo do inflamassoma. 69 – 72 IKK / NF-κB facilita a indução de autofagia, induzindo a expressão de um receptor de autofagia, p62 (também chamado SQSTM1), mediando o recrutamento de mitocôndrias danificadas para a depuração autofágica através de um mecanismo dependente de ubiquitina. 68
A ablação específica da célula mielóide p62 resulta em acúmulo aberrante de mitocôndrias danificadas e produção excessiva de IL-1β, associada à hiper-sensibilidade ao choque induzido por endotoxina. Coletivamente, esses achados sugerem que o NF-κB medeia o sinal de ativação da ativação do inflamassoma NLRP3, a indução da expressão de p62 e a mitofagia por NF-κB podem servir como um mecanismo autoregulatório para restringir sua função pró-inflamatória.



Um comentário
Artigo muito profundo que requer grande conhecimento da área imunologica.