METAIS PESADOS
Os metais pesados são normalmente referenciados como representando perigo para a saúde humana por não se decomporem no ambiente (Meadows-Oliver, 2012).
Contudo, alguns destes metais como o cobalto (Co), crómio (Cr), cobre (Cu), Manganês (Mn) e Zinco (Zn) são essenciais, em pequenas concentrações, para os mecanismos biológicos, mas também são tóxicos em concentrações elevadas.
Existem outros que apenas exibem toxicidade e levantam maiores preocupações para a saúde humana e ambiental, como o arsénio (As), cádmio (Cd), chumbo (Pb), mercúrio (Hg), tálio (Tl) e Urânio (U) (Alloway, 1995).
Neste artigo vamos tratar especificamente do Mercurio – Hg
Daremos uma introdução resumida e posteriormente, detalhes de todas as reações químicas e bioquímicas envolvidas.
MERCURIO – parte 1
APRESENTAÇÃO GERAL
O mercúrio é um elemento químico com número atómico 80 e massa molar 200,59.
Pertence ao grupo 12 da tabela periódica, integrando a classe dos metais de transição. Tem sete isótopos naturais, podendo encontrar-se em três estados de oxidação (0, +1, +2) (Watt, 2004; Cunha, 2008). (tabela periódica abaixo para referência)
É o único metal líquido à temperatura ambiente, uma vez que o seu ponto de fusão é de -39ºC, apresentando como propriedades a baixa resistividade elétrica, elevada tensão superficial, elevada condutividade térmica, uma uniforme expansão de volume ao longo da gama líquida e facilidade em formar ligas com outros metais (ÁlvarezCaicoya et al., 2011; Nunes, 2009; Watt, 2004).
O seu ponto de ebulição é de 356ºC a 1 atm, a solubilidade é de 49,4×10-6 g.L-1 a 20ºC (relativamente insolúvel na água) e a pressão de vapor de 0,180 Pa igualmente a 20ºC.
Estas características anormais são causadas pelas fracas ligações interatómicas, derivadas do núcleo ter uma força atrativa elevada relativamente aos seus elétrons de valência (Bank, 2012; Nunes, 2009).
O Hg tem tido variadas utilizações ao longo dos tempos, especialmente devido à sua elevada densidade. É usado em barómetros, manómetros, baterias, lâmpadas fluorescentes, interruptores, conversores de eletricidade, revestimento de submarinos e termómetros, uma vez que o Hg tem uma elevada taxa de expansão térmica que é constante durante as variações de temperatura (Álvarez-Caicoya et al., 2011; Bank, 2012; Cunha, 2008). É igualmente usado na indústria e na medicina há séculos. Industrialmente o Hg é utilizado na produção eletrolítica de cloreto de sódio a partir de cloreto de sódio (indústria cloro-alcali) e formulação de pesticidas, por exemplo (Cunha, 2008; Guilherme, 2007). Na medicina, era bastante utilizado na desinfeção.
O Hg é um elemento natural encontrado na crosta terrestre, ar, solo e água, com uma abundância de 0,5 µg.g-1, é naturalmente libertado para o ambiente por fontes naturais (Meadows-Oliver, 2012; Nunes, 2009) e por fontes antropogênicas.
Estimou-se que as emissões de todas as fontes (naturais e antropogênicas) são de cerca de 5000 a 6000 ton.ano-1, das quais as fontes naturais contribuem com mais de 60% para o balanço global atmosférico.
As emissões antropogênicas causaram uma contaminação mundial por Hg em diversos ecossistemas terrestres e aquáticos, com um aumento deste metal na atmosfera de duas a cinco vezes, desde o início da industrialização.
Existe uma enorme variedade de fontes de emissão antropogênicas, que provocam a libertação de Hg para a atmosfera, que podem ser pontuais ou difusas.
No tipo de emissões pontuais temos os processos de fabricação de metais ferrosos e não ferrosos, produção de substâncias químicas, processamento de minérios, fabricação de cimento e queima de carvão.
Nas emissões difusas temos aterros, solos alterados pela descarga de esgotos e desperdícios de minas (Liu et al., 2010; Nunes, 2009).
Uma vez libertado para a atmosfera, o Hg pode ser transportado, transformado e depositado na superfície terrestre (Andrew & Nriagu, 1979; Nunes, 2009).
FORMAS DE MERCÚRIO
RESUMO GERAL: Mercúrio: formas químicas e efeitos principais
• Metálico ® Hg0 : Efeitos neurotóxicos centrais (perda de memória, tremor, distúrbios de humor) e muito leves (teóricos) nos rins. (Hidrarigirismo e micromercurialismo)
• Iônico ® Hg+ : Efeitos renais importantes e leves (teóricos) em SNC. No passado sais de mercúrio foram usados como diuréticos e alguns eram era usados EV.
• Orgânico ® R–Hg : Efeitos neuróticos centrais (surdez, cegueira) e periféricos (paralisias e perda de sensibilidade), e teratogênese. (Doença de Minamata)
Resumindo: Mercurio metálico, sais orgânicos e sais inorgânicos.
O mercúrio metálico existe na sua forma elementar e encontra-se em numerosos compostos químicos.
Temos os sais orgânicos e os sais inorgânicos
RESUMO DOS EFEITOS DO MERCURIO NO ORGANISMO (será mais detalhado no decorrer da matéria)
Mercúrio metálico (Hg0 CAS 7439-97-6)
Líquido volátil a temperatura ambiente. (Ponto de fusão: -39 °C Ponto de ebulição: 356 °C)
Absorção por pele e pulmão ( cerca de 80% do inalado é absorvido) mas não há absorção pelo TGI (<0,01%)
Como não tem carga elétrica tem distribuição fácil no corpo e penetra no SNC.
É oxidado a Hg+ ou Hg+2 pela catalase e excretado principalmente pela urina, e ainda pelas fezes e um pouco pelo suor
O t1/2 biológico é complexo, mas quase tudo Hg0 absorvido é eliminado em 2 meses, mas no SNC permanece por mais tempo (2anos?)
Efeitos sub-agudos
• Em concentrações muito elevadas (800-900 µg/m3 ) causa pneumonite química com elevada mortalidade.
• Em concentrações menores pode ocorrer quadros irritativos de vias aéreas e na sequência ocorre um quadro que envolve o SNC com tremores e fasciculações musculares, alterações de comportamento, e ainda um quadro renal com hematúria e oligúria, que pode evoluir para insuficiência renal por necrose tubular proximal.
• O afastamento da exposição, em geral, reverte o quadro.
Efeitos crônicos (é o que mais nos preocupa)
• A exposição a baixas concentrações causa efeitos em SNC
Quadro inicial: Micromercurialismo: quadro astênico-vegetativo pouco específico como fraqueza, cansaço fácil, anorexia, perda de peso, e alterações neurocomportamentais. Se a exposição é a concentrações relativamente baixas (30-80 µg/m3 ) este quadro se mantém indefinidamente, até o afastamento da exposição e geralmente há melhora após o afastamento
• Se a exposição é maior (> 100 µg/m3 ) pode ocorrer evolução para o Hidrargirismo (ou Mercurialismo), que é caracterizado por alterações de humor caracterizados por irritabilidade, agitação, tremores, perda da memória recente, insônia e depressão. Em casos graves pode aparecer alucinações e delírios.
• O tremor é fino, desaparece durante o sono e é interrompido periodicamente com o aparecimento de um movimento grosseiro e descontrolado (“hatter’s shakes”). O afastamento da exposição não reverte totalmente os danos ao SNC, podendo haver alguma melhora, mas casos graves e com longa exposição geralmente não apresentam melhora significativa.
• Pode aparecer ainda neuropatia periférica sensitiva, com parestesias de extremidades, gengivite frequentemente acompanhada com perda de dentes. Estas alterações geralmente desaparecem poucas semanas após o afastamento da exposição.
• Na intoxicação crônica por Hg0 não são observadas lesões em outros órgãos, como rins.
Mercúrio iônico – Inorgânico (sais e óxidos) Exemplos:
• cloreto mercúrico (HgCl2 CAS 7487-94-7),
• cloreto mercuroso ou calomelano (Hg2Cl2 CAS 10112-91-1)
• nitrato mercúrico ou nitrato de mercúrio II (Hg(NO3 )2 CAS 10045-94-0)
• óxido mercúrico ou óxido de mercúrio II (HgO CAS 21908-53-2)
Absorção: basicamente pelo TGI (pele e pulmões são desprezíveis) A excreção é principalmente por via renal
Efeitos da contaminação ou intoxicação por sais e óxidos de mercúrio:
Intoxicação aguda por compostos inorgânicos de Hg geralmente é por ingestão acidental ou tentativa de suicídio. A dose única de 1 grama ingerida de uma vez é geralmente fatal. Leva a diarreia intensa com sangue e IRA.
Intoxicação crônica ocupacional por compostos inorgânicos de mercúrio é rara. O mais comum é a exposição simultânea ao mercúrio metálico em forma de vapor e ao composto inorgânico em processos industriais, e neste caso, o principal problema é o Hg0
Uma dermatite grave (acrodímia) é causada por compostos inorgânicos de mercúrio.
É caracterizada por inchaço doloroso e vermelhidão nas palmas das mãos e nas plantas dos pés, mas foi mais observada em crianças tratadas com medicamentos a base de mercuriais no passado.
Mercúrio orgânico
Os mais importantes são os alquilmercúrios.
• Hg ligados covalentemente a grupos alquil, como metil ou etil : o metilmercúrio (CH3 -Hg+ ou MeHg CAS 22967-92-6)
Importante citar que enquanto o metilmercúrio é um cátion com carga positiva que está sempre ligado em um ânion (nitrato, cloreto, etc.) e forma cristais pouco solúveis em água e solúveis em lipídeos, o dimetilmercúrio ((CH3 )2Hg CAS 593-75-8) é um liquido volátil e rapidamente absorvido através da pele e depois é demetilado no organismo formando metilmercúrio.
Absorcão: absorvidos por TGI, pulmão e pele
• Causa perda de visão, audição e equilíbrio, paralisia e perda de sensibilidade. Também causa graves malformações em fetos, principalmente em SNC.
• É denominada de “Doença de Minamata”, que surgiu no Japão na baia de mesmo nome nos anos 50, por poluição da água por MeHg lançado por uma indústria química. (suicídio dos gatos)
• Por vários anos foi uma doença misteriosa (Kybio) . Sir Donald Hunter, médico inspetor da fábricas da Inglaterra ajudou a elucidar o caso.
• Outras epidemias como a Iraque nos anos 60 por sementes tratadas com MeHg como fungicidas.
APRESENTAÇÃO DETALHADA DO MERCURIO
CLASSIFICAÇÃO DO MERCURIO QUANTO A APRESENTAÇÃO
- Compostos voláteis: Hg0 , (CH3)2Hg O dimetilmercúrio ((CH3)2Hg) é significativamente mais tóxico que o mercúrio elementar no que respeita à ingestão e encontra-se na atmosfera em concentrações negligenciáveis. Contudo, pensa-se ser ubíquo nas profundezas oceânicas (Alloway, 1995; Bank, 2012; Cunha, 2008).
- Compostos reativos inorgânicos: HgX2, HgX3-, HgX4- com X=OH- , Cl- e Br- ; HgO e partículas de aerossol, Hg2+ complexado com ácidos orgânicos. Estes compostos formam-se a partir da reação dos iões (Hg+ e Hg2+) com compostos inorgânicos, apresentando-se normalmente como pó branco ou cristais. São instáveis e quando expostos à luz e ao calor rapidamente se convertem em mercúrio elementar (Nunes, 2009).
- Espécies não reativas: Metilmercúrio (CH3Hg+ , C2H5Hg+ , CH3HgCl, CH3HgOH) e outros compostos organomercúriados; Hg(CN)2, HgS, Hg2+ ligados a átomos de S em húmus. Os compostos de mercúrio orgânicos formam-se através de ligações covalentes com carbono e enxofre. Esta ligação é quimicamente estável, não sendo quebrada por água, ácidos ou bases fracas. Podem ainda possuir ligações com um ou dois carbonos (radicais orgânicos arilo ou alquilo) e um qualquer anion.
Nota:Se o anion for um nitrilo ou um sulfato, a ligação terá um caráter iónico polar e são, por isso, mais solúveis em água.
Se, por outro lado, o anion for um cloreto, este composto terá um caráter covalente e será pouco polar, sendo mais solúvel em compostos orgânicos do que em água (Baêta, 2004; Nunes, 2009). O metilmercúrio (CH3Hg+ ) é bastante tóxico após ingestão e acumula-se rapidamente na cadeia alimentar. A conversão derivada do mercúrio inorgânico é efetuada por biometilação em microrganismos (bactérias metanogénicas) encontrados em sedimentos (Cunha, 2008). O etilmercúrio (C2H5Hg+ ) tem algumas semelhanças químicas com o metilmercúrio, mas é metabolizado mais rapidamente em mercúrio inorgânico no organismo (Cunha, 2008)
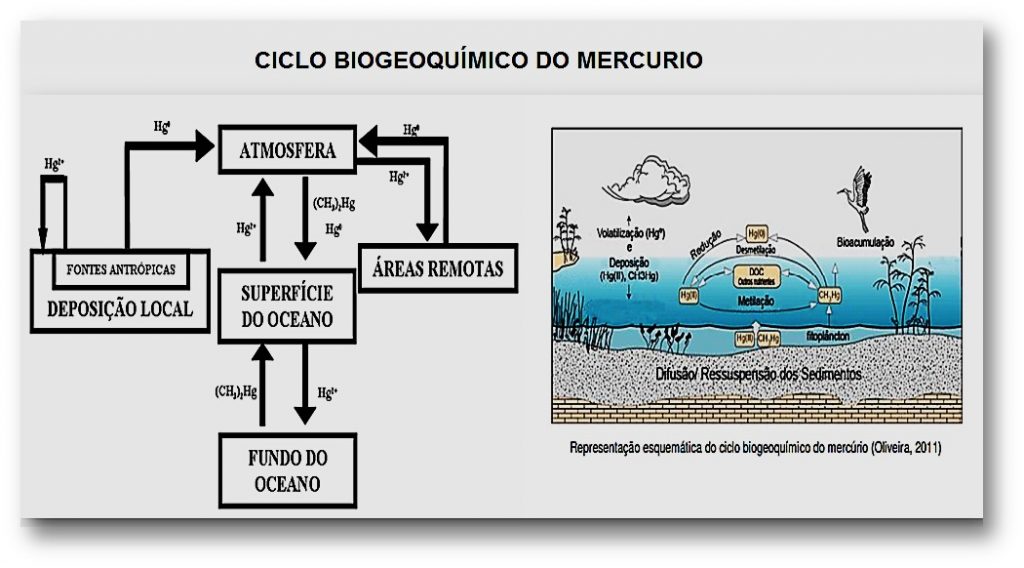
CICLO BIOGEOQUÍMICO DO MERCURIO
A circulação e a interação dos elementos entre os diferentes compartimentos ambientais (bióticos e abióticos) que resultam em processos de transferência ou transformação (químicos, físicos e biológicos), de matéria e energia é chamada de ciclo biogeoquímico.
Após a libertação no ambiente, os elementos podem sofrer várias reações bióticas (metilação, oxidação, redução) ou abióticas (dissolução, precipitação, hidrólise), gerando novas espécies químicas que afetam o seu grau de disponibilidade para os organismos (Válega, 2009).
O ciclo do mercúrio envolve os quatro compartimentos ambientais, todos ligados entre si, sendo eles o compartimento atmosférico, aquático, terrestre e biótico.
Devido às suas características químicas, o mercúrio move-se através dos vários compartimentos ambientais mudando de forma e espécie ao longo do processo (Nunes, 2009). – FICURA ILUSTRATIVA ABAIXO
ATMOSFERA O mercúrio libertado para a atmosfera, a partir das várias fontes, na forma de Hg0 sofre oxidação na interface sólido-líquido (neblina, gotículas de chuva) e através de reações mediadas pelo ozono, raios ulta violetas ou outros oxidantes atmosféricos, transforma-se em Hg2+. Este retorna ao ambiente aquático e terrestre através da água da chuva, aerossois ou absorvido em pequenas partículas, enquanto que o Hg0 pode ser transportado a grandes distâncias, devido ao tempo que o mercúrio permanece na atmosfera (Almeida, 2011; Baêta, 2004; Marques, 2010; Nunes, 2009). Cerca de 95% do mercúrio atmosférico total corresponde ao estado elementar gasoso, o qual consegue permanecer durante cerca de um ano na atmosfera (Almeida, 2011).
TERRA: As principais espécies de mercúrio encontradas neste compartimento são compostos Hg-óxidos de ferro, Hg-matéria orgânica, Hg-óxidos de manganês, sendo estas as espécies predominantes devido à oxidação de sulfureto a sulfato, redução do ferro e/ou manganês, presentes nos óxidos hidratados, Hg0 , HgCl2, Hg(OH)2, HgCl4 2-, HgCl3-, HgS2H – , HgS2 2- , HgS ou Hg adsorvido à superfície de sulfuretos minerais (Marques, 2010).
ÁGUA: No ambiente aquático, o Hg2+ é adsorvido preferencialmente na superfície dos sedimentos, ácidos húmicos, material particulado e argilas por processos de coprecipitação e correação (HgS, Hg(OH)2, HgCl2) (Baêta, 2004; Marques, 2010; Válega, 2009). O mercúrio elementar, o metilmercúrio ou o dimetilmercúrio formam complexos com ligações orgânicas, formando compostos com ligações covalentes C-Hg e complexos não lábeis de Hg com matéria orgânica. Podem ainda, ser encontrados precipitados contendo mercúrio (HgS) (Marques, 2010). Contudo, a forma química do mercúrio é fortemente influenciada pelo pH e pelo potencial de oxidação-redução, bem como pelas concentrações de compostos inorgânicos e orgânicos (Almeida, 2011). Neste ciclo, as águas naturais encontram-se frequentemente saturadas com Hg0 relativamente ao ar, o que resulta num fluxo deste metal elementar da água para a atmosfera, por volatilização (Almeida, 2011).
BIÓTICO: Bactérias, incluindo as redutoras de sulfato, transformam o Hg2+ por metilação em metilmercúrio (CH3Hg+ ) e dimetilmercúrio ((CH3)2Hg) na interface água-sedimento e também, no perifiton das macrófitas aquáticas (Baêta, 2004; Marques, 2010; Válega, 2009). Por outro lado, a hidrólise do metilmercúrio é termodinamicamente favorável, mas cineticamente impedida, permanecendo este composto estável nas soluções aquosas (Almeida, 2011). O CH3Hg+ é rapidamente absorvido pelos organismos marinhos e, desta forma, será bioacumulado ao longo da cadeia trófica. Em menor extensão, o CH3Hg+ é também desmetilado, por microrganismos ou por processos fotoquímicos, a Hg2+ e posteriormente reduzido a Hg0 retornando à atmosfera e diminuindo a toxicidade nestes ambientes (Almeida, 2011; Baêta, 2004, Marques, 2010; Válega, 2009).
O mercúrio é convertido em formas químicas e estados de oxidação diferentes dentro dos organismos.
Através de processos enzimáticos, o mercúrio elementar pode ser oxidado a outras formas inorgânicas, bem como, compostos de mercúrio orgânico podem ser convertidos em mercúrio inorgânico. Os efeitos adversos dependerão da forma química do mercúrio incorporado, da via de exposição (inalação, ingestão e contacto dérmico) e da intensidade da exposição, uma vez que o metilmercúrio é acumulado por peixes e mamíferos marinhos, podendo a sua concentração ser bastante superior em espécies predadoras do topo da cadeia alimentar, relativamente aos valores encontrados na água e no fitoplâncton (Baêta, 2004; Oliveira, 2011).
continua….