Vamos trazer esta matéria como um conteúdo integrativo para auxiliar e complementar os tratamentos.
Em oncologia, o efeito Warburg ([ˈvɑrbʊərɡ]) é a observação de que a maioria das células cancerígenas libera energia predominantemente não por meio do ciclo do ácido cítrico “usual” e da fosforilação oxidativa na mitocôndria, como observado nas células normais, mas por meio de um processo menos eficiente de “glicólise anaeróbica”, que consiste em um alto nível de captação de glicose e glicólise seguida de fermentação de ácido lático que ocorre no citosol, e não nas mitocôndrias, mesmo na presença de oxigênio abundante. Essa observação foi publicada pela primeira vez por Otto Heinrich Warburg, que recebeu o Prêmio Nobel de Fisiologia de 1931 por sua “descoberta da natureza e do modo de ação da enzima respiratória”. O mecanismo preciso e as implicações terapêuticas do efeito Warburg, no entanto, permanecem desconhecidas.
Algumas leituras importantes para esse tema.
Compreendendo o Efeito Warburg: Os Requisitos Metabólicos da Proliferação Celular
O Efeito Warburg: Como ele beneficia as células cancerígenas?
Metabolismo tumoral, transportadores de células cancerígenas e resistência microambiental
Vou trazer aqui um artigo de uma nutricionista altamente conceituada e capacitada, Andrea Torres . Um ótimo artigo para pessoas não ligadas a saúde por trazer explicações claras.
Aqui, para falar desse efeito, vamos iniciar explicando que não obtemos energia de pão, macarrão, carne, fruta, abacate ou pudim. Obtemos energia a partir de adenosina tri fosfato (ATP). Assim, o corpo é obrigado a transformar tudo o que come nesta molécula. As duas principais vias metabólicas que fornecem energia para as células são a glicólise e a fosforilação oxidativa (OXPHOS).
A glicólise é a forma anaeróbica (sem oxigênio) de geração de ATP. Nesta via, a glicose (de 6 carbonos) é quebrada ao meio, formando duas moléculas de 3 carbonos e liberando 2 ATP. É uma via relativamente ineficiente em comparação com a forsforilação oxidativa (OXPHOS), que consome oxigênio mas gera outros 32 a 34 ATP.
As células saudáveis usam apenas a glicólise em condições anaeróbicas, enquanto, ao contrário, as células malignas principalmente dependem da glicólise, mesmo na presença de oxigênio suficiente, levando a um estado denominado “glicólise aeróbica”. Este fenômeno, pelo qual as células cancerígenas dependem da glicólise para a produção de ATP, em vez de OXPHOS, foi relatado pela primeira vez pelo Dr. Warburg em 1955 e, portanto, é conhecido como Efeito Warburg.
Os efeitos antitumorais da dieta cetogênica emanam de sua capacidade de criar um microambiente tumoral deficiente em glicose, forçando as células saudáveis a obterem energia a partir da oxidação (queima) de ácidos graxos por meio de OXPHOS.
A estratégia reduz a proliferação de células tumorais, uma vez que estas são ineficientes no uso de ácidos graxos (gorduras) para a produção de ATP.
Os efeitos antitumorais da dieta cetogênica emanam de sua capacidade de criar um microambiente tumoral deficiente em glicose, forçando as células saudáveis a obterem energia a partir da oxidação (queima) de ácidos graxos por meio de OXPHOS. ASSITA O VÍDEO
A estratégia reduz a proliferação de células tumorais, uma vez que estas são ineficientes no uso de ácidos graxos (gorduras) para a produção de ATP.
Mecanismos envolvidos na progressão malígna
Estudos anteriores em animais descobriram que a dieta cetogênica altera a expressão de várias proteínas envolvidas na progressão maligna. Essas moléculas incluem o receptor 2 do fator de crescimento endotelial vascular, a metaloproteinase-2 da matriz e a vimentina.
Além disso, a dieta cetogênica fortalece o efeito antiangiogênico da ciclofosfamida, que causa hipóxia nas células tumorais. Normalmente, o gene da anidrase carbônica IX (CAIX) é expresso durante a hipóxia como uma resposta ao estado ambiental de baixo oxigênio, mas a dieta cetogênica combinada com a medicação em baixa dose não leva a tal resposta, apesar de sua inibição da angiogênese.
Mecanismos envolvidos na progressão malígna
Estudos anteriores em animais descobriram que a dieta cetogênica altera a expressão de várias proteínas envolvidas na progressão maligna. Essas moléculas incluem o receptor 2 do fator de crescimento endotelial vascular, a metaloproteinase-2 da matriz e a vimentina.
Além disso, a dieta cetogênica fortalece o efeito antiangiogênico da ciclofosfamida, que causa hipóxia nas células tumorais. Normalmente, o gene da anidrase carbônica IX (CAIX) é expresso durante a hipóxia como uma resposta ao estado ambiental de baixo oxigênio, mas a dieta cetogênica combinada com a medicação em baixa dose não leva a tal resposta, apesar de sua inibição da angiogênese.
Isso ocorre porque a dieta cetogênica reduz a expressão do fator-1 alfa induzível por hipóxia (HIF-1α) e, subsequentemente, a expressão de CAIX, levando à redução da microvasculatura do tumor.
A dieta cetogênica também reduz a expressão de serina/treonina quinase Akt (Proteína quinase B). Normalmente, Akt aumenta em células cancerígenas humanas e leva a proliferação celular aumentada, mais mutação e inibição da apoptose (morte destas células). Akt estimula a produção de espécies reativas de oxigênio (ROS) e seu acúmulo; no entanto, a dieta cetogênica reduz a produção de ROS ao mesmo tempo em que aumenta os antioxidantes no sangue. A redução de ROS melhora a função mitocondrial nas células saudáveis.
Menor resistência ao estresse e 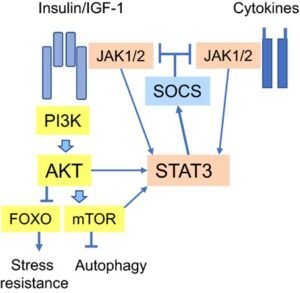 menor capacidade de regeneração celular e apoptose de células tumorais.
menor capacidade de regeneração celular e apoptose de células tumorais.
Os baixos níveis de glicose associados à dieta cetogênica reduzem a atividade da via das pentoses fosfato. A via das pentoses fosfatos gera NADPH para uso em reações de biossíntese redutiva e geração reduzida de glutationa (GSH). A dieta cetogênica diminui essa fonte de energia que também está associada ao aumento da geração de espécies reativas de oxigênio (ROS) e à toxicidade das células cancerígenas.
Além disso, essa depleção de energia inibe o ciclo celular por meio da ativação da via LKB1/AMPK e da inibição da via do mTOR. As células cancerígenas tentam compensar sua ineficácia mitocondrial aumentando a glicólise e ativando a via das pentoses fosfato. A glicólise produz energia a partir da glicose (2 ATPs), mas a função mais importante da glicólise é que a maioria dos intermediários dessa via é necessária para várias vias de biossíntese essenciais para a proliferação celular. Assim, a glicose é necessária para a produção de proteínas, nucleotídeos e ácidos graxos pela célula tumoral e a dieta cetogênica, ao reduzir a glicólise impede esta ocorrência.
Uma forma de reduzir o número de células cancerígenas seria matando-as de fome. Estudos experimentais mostram que, em longos períodos de jejum, as células cancerígenas são mais mais vulneráveis ao tratamento do câncer. Mas o paciente não pode ficar sem comer para sempre. Mas a dieta cetogênica imita o jejum para a célula cancerígena. A redução de carboidratos reduz a disponibilidade de insulina e fator de crescimento semelhante à insulina 1 (IGF1) no sangue.
O IGF1 é essencial para o crescimento celular e, portanto, sua redução causa redução da proliferação tumoral. A dieta cetogênica também pode alterar a expressão de genes relacionados ao estresse oxidativo e inflamação em células tumorais.
Por fim, é relatado que a dieta cetogênica diminui os aminoácidos (AAs) no plasma e dentro do tumor, mas uma dieta normal com baixa proteína não leva a essa diminuição. Portanto, corpos cetônicos altos podem ser o motivo de um declínio nos AAs. Isto é importante pois aminoácidos essenciais e dos metabólitos do ciclo da uréia, aumentam a produção de glutamina, que o tumor também ama.
Apesar dessas vantagens potenciais, a dieta cetogênica não é uma opção de tratamento adequada para todos os tipos de câncer. Por exemplo, é relatado que a proliferação de células cancerígenas aumentou em células de melanoma com mutação BRAF V600E com dieta cetogênica. Também discute-se a viabilidade da dieta cetogênica no câncer renal (Makuku et al., 2023).
Esclarecemos a todos que o material que trazemos em nossos artigos devem servir, APENAS, de informação jamais de resoluções pessoais. Caso se interesse, procure seu médico, passe o material, passe nosso contato. Estamos a disposição para auxiliar na melhoria da Qualidade de Vida. A medicina Integrativa é a nossa referência.
Dra. Célia Wada – CRF SP 7043 – CRF RJ 34658

