Trouxemos esta apresentação visto a importância de conhecer esse parâmetro na terapia por Ozônio do paciente.
OBJETIVIDADE DA APRESENTAÇÃO: G6PD X OZÔNIOTERAPIA
Todo e qualquer procedimento deve ser precedido de rigorosa anamnese, assim como ser precedido de análise técnica de procedimentos (riscos/benefícios)
A deficiência de glicose-6-fosfato desidrogenase (G6PD) é um distúrbio genético hereditário que pode resultar na destruição de glóbulos vermelhos (hemólise) depois de uma doença aguda ou uso de certos medicamentos.
A deficiência da G6PG – Glicose 6 Fostato Desidrogenase é a deficiência enzimática mais comum do mundo. Aproximadamente 400 milhões de pessoas são afetadas em todo mundo. Existe grande variabilidade de gravidade com base na mutação herdada.
BREVE RESUMO DA ENZIMA G6PD – G6PD – CLICOSE 6 FOSTATO DESIDROGENASE
A G6PD é uma enzima que contribui para o metabolismo da glicose com a consequente geração de energia.
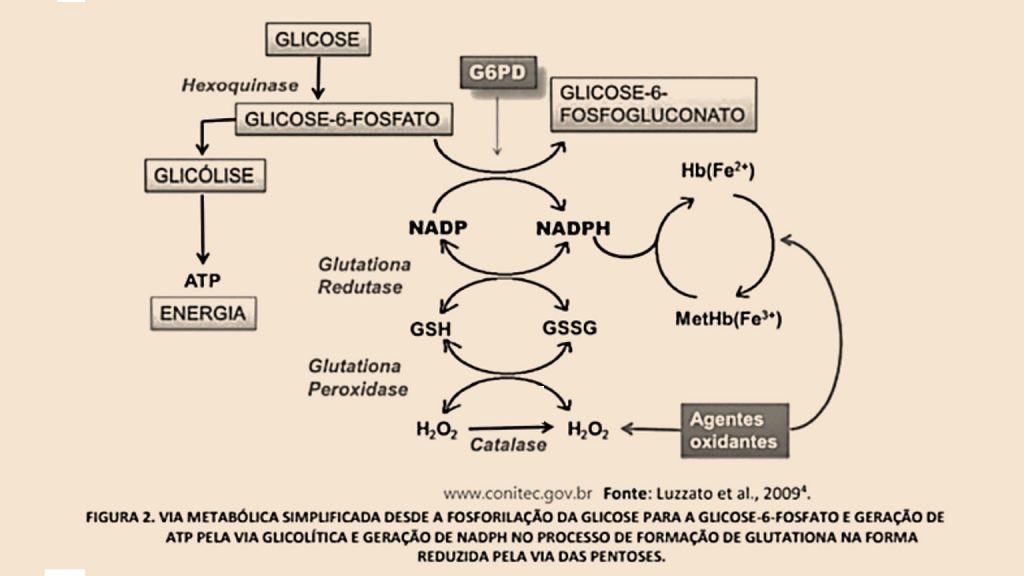
É uma enzima citoplasmática presente em todas as células do corpo, que tem como função de catalisar a primeira etapa da rota metabólica da hexose monofosfato e, sendo assim, é essencial para a produção de NADPH, responsável por combater efeitos prejudiciais das espécies reativas de oxigênio e radicais livres
O eritrócito é uma célula particular porque transporta oxigênio para os tecidos sem consumi-lo. A adenosina trifosfato (ATP), energia calórica, e a nicotinamida adenina dinucleotídeo reduzida (NADH) e nicotinamida adenina dinucleotídeo fosfato reduzida (NADPH), energia redutora, são obtidas a partir da oxidação anaeróbica da glicose, via das pentoses e ciclo da glutationa.
A via das pentoses é responsável pela oxidação de cerca de 10% da glicose consumida pelo glóbulo vermelho. A ação de duas enzimas seqüenciais, a glicose-6-fosfato desidrogenase (G6PD) e a 6-fosfogliconato desidrogenase (6PGD) reduzem a coenzima nicotinamida adenina dinucleotídeo fosfato (NADP) à nicotinamida adenina dinucleotídeo fosfato reduzida (NADPH), sendo, praticamente, toda fonte geradora de NADPH. Ao manter a glutationa no estado reduzido (GSH), através da glutationa redutase, essa via desempenha importante papel na proteção do glóbulo vermelho frente aos processos oxidativos, que são responsáveis pela redução da vida média do eritrócito.
A deficiência de G6PD é a mais freqüente enzimopatia conhecida, afetando aproximadamente 400 milhões de pessoas no mundo. Os eritrócitos deficientes de G6PD são incapazes de reduzir NADP+ a NADPH em velocidade normal, apresentando assim um baixo potencial redutor, não conseguindo remover o peróxido de hidrogênio ou os dissulfetos mistos da hemoglobina formados após ingestão de certas drogas oxidantes e em alguns processos infecciosos e oxidativos. Ocorre hemólise autolimitada pela destruição dos eritrócitos senis, com conseqüente aumento de reticulócitos que apresentam maior quantidade da enzima.
A deficiência de G6PD é um modelo de interação genótipo-fenótipo, visto que os pacientes são, em sua maioria, assintomáticos, a não ser quando manifestaram o estresse oxidativo.
A grande maioria dos portadores são assintomáticos, e descobrem esta deficiência enzimática após o uso de determinados fármacos, alimentos ou corantes. A G6PD é uma enzima citoplasmática capaz de produzir substâncias que as protegem as células dos fatores oxidantes. A diminuição da atividade desta enzima afeta os eritrócitos tornando-os mais vulneráveis aos danos oxidativos, e a possibilidade de serem retirados da circulação em menos de 120 dias. Nesses momentos os pacientes apresentam anemia hemolítica aguda (AHA), uma manifestação hematológica importante.
Histórico
No século 19, pediatras gregos, italianos e portugueses observaram a ocorrência de anemia severa e hemoglobinúria em crianças após o consumo de feijões de fava, daí a alcunha de favismo. A observação mostrou que o favismo era recorrente nas mesmas pessoas e estava presente em famílias. Nos anos 1920, verificou-se que alguns pacientes, quando eram tratados para malária com primaquina e plasmoquina, apresentavam AHA. Não havia suspeita de que ambas as manifestações estavam conectadas.
Em 1956, um grupo de Chicago relatou que as hemácias das pessoas sensíveis à primaquina eram deficientes em G6PD. Pouco depois, em 1958, outro grupo em Genova na Itália encontrou a mesma deficiência em crianças com história anterior de favismo. Os achados combinados apreciaram que as duas manifestações foram causadas pela deficiência de G6PD e que essa era a genética e a herança foram transmitidas ao X.
Mecanismo de ação – Bases bioquímicas
A G6PD é uma enzima que ‘ORGANIZA SEU ORGANISMO” está presente em todas as células do organismo e age como a primeira enzima do ciclo das pentoses. Apesar de o produto final de sua reação ser a formação de uma pentose, é importante ressaltar que a sua atividade gera duas manifestações de NADPH, sendo esse seu trunfo principal. O NADPH é um doador de elétrons importantes em muitos processos celulares. Na maioria das células, outras enzimas também controlam NAPDH e, mesmo que haja deficiência de G6PD, isso não ocasionará problemas.
O mesmo não pode ser dito para as hemácias, que sacrificam muitas de suas organelas e enzimas na sua habilidade para exercer sua principal função de carregamento de oxigênio. Radicais livres podem ser produzidos no processo de transporte de oxigênio nas hemácias, nesse ponto o NADPH é fundamental para combater o estresse oxidativo.
A deficiência de G6PD nunca é completa e, caso fosse completa, seria fatal. A atividade residual da G6PD presente é capaz de manter as hemácias funcionando, mas não limita sua atividade. Quando ocorre um estresse oxidativo exógeno, as células não são capazes de aumentar sua produção de NADPH; consequentemente, a hemoglobina e outras proteínas são danificadas e as células são eventualmente abocanhadas por macrófagos ou sofrem hemólise devido ao dano.
Base genética da G6PD
O gene que codifica a enzima G6PD se encontra no braço longo dos cromossomos X (Xq28), o que demonstra a já mencionada herança ligada ao X. Isso acarreta algumas possibilidades fenotípicas.
A deficiência de G6PD não é mais comum em homens; apesar de mulheres homozigotas serem muito mais raras que homens hemizigotos, mulheres heterozigotas são muito mais numerosas. Por que isso é importante? Porque na prática clínica você vai encontrar mulheres heterozigotas onde o fenótipo de atividade da G6PD se apresenta como normal e em outras o fenótipo se mostra como a deficiência de G6PD, assim como visto nas homozigotas.
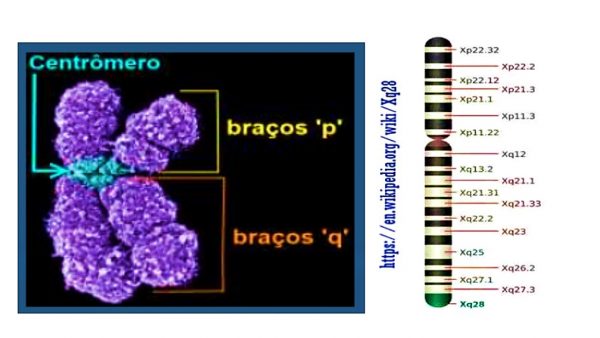
Os pares de cromossomos humanos são numerados de 1 a 22, sendo iguais para homens e mulheres.
É no 23º que está a diferença, ou seja, para os homens o par é X Y e para as mulheres é X X.
Cada cromossomo tem um braço curto chamado de “p” e um braço longo “q”. Além disso há várias subdivisões em bandas numeradas. A deficiência da G6PD é resultado de uma diferença no gene Xq28.
São mais de 300 variantes desta deficiência.
Manifestações clínicas
A deficiência de G6PD, apesar de na maior parte da vida das pessoas se manter sem repercussão, pode se manifestar clinicamente de três formas. É possível encontrar uma deficiência de G6PD como icterícia neonatal, anemia hemolítica aguda e anemia hemolítica crônica não esferocítica. A deficiência de G6PD torna o eritrócito suscetível ao estresse oxidativo, o que diminui a sobrevida dos eritrócitos. A hemólise ocorre depois de estresse oxidativo, comumente após febre, infecção bacteriana ou viral aguda e cetoacidose diabética. A hemólise é episódica e autolimitada, embora raros pacientes tenham hemólise crônica e contínua na ausência de estresse oxidativo.
Com menor frequência, a hemólise ocorre após a exposição a fármacos ou outras substâncias que produzam peróxido e causem oxidação da hemoglobina e membranas dos eritrócitos. A quantidade da hemólise depende do grau de deficiência de G6PD e do potencial oxidante do fármaco.
Exemplos:
Icterícia neonatal
Os recém-nascidos sempre apresentam um certo nível de hiperbilirrubnemia devido à necessidade de absorção da bilirrubina que antes era excretada pela placenta. Icterícia neonatal é definida como altos níveis de bilirrubinas para o peso e idade do recém-nascido. Se não for tratado, pode evoluir para o kernicterus, uma encefalopatia crônica que ocasiona atraso no desenvolvimento neuropsicomotor.
Uma das causas de icterícia neonatal é a deficiência de G6PD, mas não se sabe ao certo o seu mecanismo nessa ocorrência, e a deficiência de G6PD aumenta a incidência de icterícia em neonatos tanto do sexo feminino quanto masculino. Postula-se que neonatos deficientes de G6PD apresentam um turnover de heme maior, mas sem anemia ou com graus de anemia.
Anemia hemolítica aguda
A AHA é a apresentação mais clássica de deficiência de G6PD. Manifesta-se como episódios agudos de hemólise intravascular em um paciente previamente assintomático, geralmente após a ingestão de certos medicamentos ou alimentos e diante de infecção. Os sintomas da AHA são mal-estar, dor abdominal e lombar, hematúria, icterícia e palidez. Níveis elevados de LDH e manchas de sangue com anisocitose, policromasia e poiquilócitos são encontrados precocemente em episódios de AHA. Os reticulócitos também estão presentes como forma de resposta da medula óssea à hemólise. Favismo é o nome utilizado para AHA causado por feijão de fava, que contém divicina, um potente agente oxidante.
O curso da hemólise é normalmente autolimitado, possivelmente porque as células mais velhas (que apresentam níveis mais baixos de G6PD) são mais propensas à lise e são substituídas por células jovens que conseguem combater a agressão oxidativa.
Anemia hemolítica crônica não-esferocítica
A anemia hemolítica crônica não esferocítica é uma manifestação rara da deficiência de G6PD que ocorre em homens com variantes esporádicas da enzima. Ela se manifesta quando a hemácia não consegue manter níveis suficientes de NADPH para evitar o estresse oxidativo de seu próprio metabolismo. Por isso mantém um processo de hemólise crônica e o paciente apresenta icterícia, anemia, aumento de cálculos biliares, esplenomegalia e pode necessitar de suporte transfusional crônico. Os pacientes com a forma crônica podem apresentar quadros agudos quando expostos às mesmas que os outros pacientes, porém a dose necessária é geralmente menor para causar a crise hemolítica
Dosagem/ determinação da G6PD
1- Imagem
– Esfregaço periférico

A falha na função da G6PG diminui a geração de GLUTATIONA. Caso essas funções não ocorram, a hemoglobina da célula não irá se ligar ao O2, acabará por sofrer ruptura da membrana levando a hemólise. A desintegração do tetrâmero de hemoglobina gera polipeptídios desagregados precipitam-se no interior dos eritrócitos sob forma de corpos de Heinz.
– Teste de fluorescência
 O diagnóstico é feito sumariamente pela avaliação do teste de pontos de fluorescência ou análise quantitativa da atividade de G6PD por espectrofotometria. O teste de fluorescência é rápido e barato, porém ele pode apresentar falso negativo em mulheres heterozigotas, visto que as hemácias são as que não acompanham hemólise e, por sua característica de mosaico, esses pacientes apresentam um teste normal. Alguns pacientes e famílias se beneficiam da avaliação genética da mutação para descrição, mas esses testes são sumariamente utilizados em pesquisa.
O diagnóstico é feito sumariamente pela avaliação do teste de pontos de fluorescência ou análise quantitativa da atividade de G6PD por espectrofotometria. O teste de fluorescência é rápido e barato, porém ele pode apresentar falso negativo em mulheres heterozigotas, visto que as hemácias são as que não acompanham hemólise e, por sua característica de mosaico, esses pacientes apresentam um teste normal. Alguns pacientes e famílias se beneficiam da avaliação genética da mutação para descrição, mas esses testes são sumariamente utilizados em pesquisa.
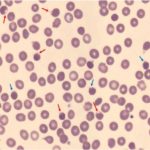
Ex: Deficiência hereditária de eritrócitos G6PD
O esfregaço de sangue é de um homem de 37 anos com deficiência hereditária de G6PD. Mostra muitas células bolhosas (flechas vermelhas) devido à precipitação da hemoglobina lesada no interior das células. Também mostra esferócitos (flechas azuis) com danos à membrana decorrente da ligação pela hemoglobina oxidada.
Imagem cedida por Jerry L. Spivak, MD.
2- Dosagem da G6PD
A dosagem laboratorial da G6PD é uma prática bastante simples. Coleta em franco com EDTA
CBHPM 4.03.02.05-9 AMB 28.01.098-
Preparo do Paciente: Jejum não obrigatório.
Método: Determinação da ação do G6PD em lisado de hemácias, em soro ou em plasma por sua ação sobre a glicose 6 fosfato.
Interpretação:
DIMINUIÇÃO: deficiência de G6PD (hemólise secundária, congênita, desencadeada por drogas ou por infecções virais e bacterianas).
AUMENTO e NORMAL: normalmente não tem significado clínico.
- O método utilizado para a determinação quantitativa da atividade da G-6-PD utilizado no laboratório é baseado na oxidação da glicose-6- fosfato (G-6-P) a 6-fosfogliconato (6-PGA) e na redução do NADP a NADPH, analisado por espectrofotometria no comprimento de onda a 340nm, conforme protocolo publicado por Beutler em 1984.
Valor de Referência: de 6,97 a 20,50 U/g hemoglobina
Fonte: Deficiência de glicose-6-fosfato desidrogenase na icterícia neonatal: avaliação de 10 anos do Instituto Adolfo Lutz-SP // Marilena OSHIRO; Vânia Maria CAÇÃO; Cristiani Martinez SALZONE Núcleo de Hematologia e Bioquímica -Centro de Patologia-Instituto Adolfo Lutz // Bol Inst Adolfo Lutz. 2014; 24(1):33-35 • 33
Sinais e sintomas:
FAVISMO – DEFICIÊNCIA DE G6PD – DOENÇA – https://www.msdmanuals.com/
Quando os sintomas se desenvolvem, incluem:
§ febre § urina escura. § dor abdominal. § dor nas costas. § fadiga. § palidez na pele. A maioria das pessoas se recupera em poucos dias sem tratamento em acometimento agudo.
Controle da G6PD
O gerenciamento da deficiência de G6DP é sobretudo preventivo.
Após o diagnóstico, é muito importante orientar o paciente sobre a lista de medicamentos e alimentos que não podem ser consumidos por esses pacientes. Condutas de educação são fundamentais.
Cada uma das apresentações da doença tem seu manejo específico. A icterícia neonatal é tratada da mesma forma que outros tipos de icterícia, através de fototerapia ou exsanguinotransfusão em casos mais graves. A AHA é inicialmente tratada através do tratamento do fator causador do estresse oxidativo, seja a suspensão de medicamentos ou ingestão de alimentos ou o tratamento infeccioso apropriado. Em casos em que a anemia se torna grave, pode-se utilizar de transfusão de concentrado de hemácias. Para a forma crônica da doença, o tratamento preventivo é ainda mais importante, visto que esses pacientes podem sofrer complicações graves em quadros de agudização.
OBJETIVIDADE DA APRESENTAÇÃO: G6PD X OZONIOTERAPIA
POR QUE É IMPORTNATE DOSAR A G6PD ANTES DO PROCEDIMENTO DE OZONIO?
Como explicado, a deficiência de glicose-6-fosfato desidrogenase (G6PD) é a doença hereditária mais comum do metabolismo dos eritrócitos e pode causar hemólise na presença de gatilhos. A incidência é mais alta em certos grupos étnicos (p. ex., afro-americanos, pessoas de origem mediterrânea, pessoas de descendência asiática). Os gatilhos incluem doenças agudas (p. ex., infecções), fármacos (p. ex., salicilatos) e outras substâncias (p. ex., favas) que causam estresse oxidativo.
A deficiência de G6PD é uma doença que muito bem demonstra a interação genótipo-fenótipo e o conceito de farmacogenética, pela sua manifestação clínica a partir da exposição ao estresse oxidativo.
O corpo humano, mediante a ativação de leucócitos, pode produzir ozônio – grande aliado da saúde em situações normais e patológicas. Ele reage com biomoléculas – poli-insaturados (PUFA) e antioxidantes – presentes no plasma (um dos componentes do sangue).
AO MINISTRARMOS OZÕNIO:
A reação entre peróxido de hidrogênio e outras possibilidades, os ROS (espécies reativas de oxigênio) e produtos de peroxidação lipídica (LOPs), levam a um súbito aumento da concentração de peróxido de hidrogênio, gerando um gradiente que acarreta sua rápida transferência para dentro das células. Depois, em poucos segundos, serão ativados vários processos bioquímicos que, simultaneamente, sofrerão redução para água pelo eficiente sistema antioxidante intracelular (GSH, catalase e GSH-Px).
Essa etapa crítica corresponde a um estresse oxidativo controlado, agudo e transitório necessário para ativação biológica – sem toxicidade concomitante, provando que a dosagem de ozônio é compatível com a capacidade antioxidante do sangue.
Enquanto as ROS são responsáveis pelos efeitos biológicos imediatos, os LOPs são importantes por seu efeito tardio, quando o sangue ozonizado retorna para a circulação por reinfusão. Os LOPs podem chegar a qualquer órgão após se ligarem ao receptor suscitando a adaptação para repetidos estresses oxidativos agudos. Eles ativarão a regulação das enzimas antioxidantes e, provavelmente, a liberação de células-tronco.
Esse controle oxidativo sem a presença da G6PD, em um ambiente onde, pela falta da G6PD já está altamente oxidado, gerará uma cascata que, se não controlada, poderá trazer danos irreparáveis.
Resumo: Com o aumento do estresse oxidativo, pode diminuir a geração de GLUTATIONA. Caso essas funções não ocorram, a hemoglobina da célula não irá se ligar ao O2, acabará por sofrer ruptura da membrana levando a hemólise.
G6PD BAIXA : significa que o indivíduo está em estresse oxidativo!
G6PD abaixo de 2,2 é aconselhável não oxidar mais o organismo, (ozônio é altamente oxidante), devemos tratar o estresse com anti oxidantes, vitamina C, vitamina E, coenzima Q10, Glutationa, etc.
Complemento:
Lista de medicamentos e alimentos não recomendados para pacientes com deficiência de G6PD.
Analgésicos:
Aspirina, acetofenitidina, probenecida
Antimaláricos
Cloroquina, hidroxicloroquina, primaquina, quinino
Citotóxico/Antibacterianos
Cloranfenicol, sulfametoxazol+trimetropim, ácido nalidíxico, nitrofurantoína
Drogas Cardiovasculares
Dapsona, sulfametoxipirimidina, sulfapiridina, sulfanilamida, sulfasalazina
Outros compostos
Alfa-metildopa, ácido ascórbico, hidralazina, azul de metileno, naftaleno (naftalina), urato oxidase, Vitamina K
Alimentos
Feijão de fava, água tônica, vinho tinto, mirtilos (mirtilo)
Célia Wada – CRF-SP – 7043
Referências:
- Luzzatto L, Nannelli C, Notaro R. Deficiência de glicose-6-fosfato desidrogenase. Vol. 30, Clínicas de Hematologia/Oncologia da América do Norte. WB Saunders; 2016. pág. 373–93.
- Cappellini MD, Fiorelli G. Seminário Deficiência de glicose-6-fosfato desidrogenase [Internet]. Vol. 371, www.thelancet.com. 2008. Disponível em: www.thelancet.com
- Associazione Italiana Favismo – www.g6pd.org
- Mason PJ, Bautista JM, Gilsanz F. Deficiência de G6PD: a associação genótipo-fenótipo. Análises de Sangue. 2007;21(5):267–83.
- Luzzatto L, Seneca E. Deficiência de G6PD: Um exemplo clássico de farmacogenética com implicações clínicas contínuas. Vol. 164, British Journal of Hematology. 2014. pág. 469–80.
- Atividade da 6-fosfogliconato desidrogenase em deficientes de glicose Activity of 6-phosphogluconate dehydrogenase in glucose-6-phosphate dehydrogenase deficiency – Daniela B. NicolieloRosecler I.P. FerreiraAmauri A. Leite https://www.scielo.br/j/rbhh/a/JncptYxwT763Pps5GqkMzfP/?lang=pt#:~:text=As%20enzimas%20G6PD%20e%206PGD,estresse%20oxidativo%20metab%C3%B3lico%20nos%20eritr%C3%B3citos.
- Deficiência de glicose-6-fosfato desidrogenase na icterícia neonatal: avaliação de 10 anos do Instituto Adolfo Lutz-SP – Marilena OSHIRO; Vânia Maria CAÇÃO; Cristiani Martinez SALZONE Núcleo de Hematologia e Bioquímica -Centro de Patologia-Instituto Adolfo Lutz – Bol Inst Adolfo Lutz. 2014; 24(1):33-35 • 33
- Leite AA. Icterícia neonatal e deficiência de glicose-6-fosfato desidrogenase. Rev Bras Hematol Hemoter. 2010; 32(6):430- 431.
- Algur N, Avraham I, Hammerman C, Kaplan M. Quantitative Neonatal Glucose-6-Phosphate Dehydrogenase Screening: Distribution, Reference Values, and Classification by Phenotype. J Pediatric. 2012; 161(2):197-200.
- Kaplan M, Hammerman C. Glucose-6-phosphate dehydrogenase deficiency and severe neonatal hyperbilirubinemia: a complexity of interactions between genes and environment. Semin Fetal Neonatal Med. 2010; 15:148-156.
- WHO Working Group. Glucose-6-phosphate dehydrogenase deficiency. Bull World Health Organ. 1989; 67(6):601-611.
- Laboratório Hérmes Pardini



Um comentário
o tratamento de ozonioterapia é muito deficiente,meu esposo se submeteu a esse tratamento e só gastou dinheiro em vão e ainda colocou sua vida em risco,pois ao longo do tratamento que foi identificado que estava com a G6pd baixa e isso traz uma série de consequências.
ROSA MARIA
Infelizmente, o procedimento errado de certas clínicas faz com que essa terapia complementar maravilhosa seja prejudicada. JAMAIS uma pessoa pode INICIAR um tratamento com ozonio sem ter dosado previamente o G6PD. As pessoas fazem as coisas sem saber…isso é péssimo.
A dosagem do G6PD é primordial. Veja nos artigos, as contra indicações da ozonioterapia…isso é básico…
Sinto muito que o local nde seu marido foi fazer o tratamento não tomou essa providência…
VEJA OZÔNIO apesar de ser o 4º mais potente oxidante da terra, em doses baixas, em doses adequadas ele é capaz de gerar um Estresse Oxidativo de maneira passageira, controlada e progressiva, estimulando o Sistema Anti–Oxidante a se tornar, a cada aplicação, mais resistente e eficiente.
Como isso ocorre:
Quando entra em contato com os fluídos do corpo humano sofre uma reação de oxidação, em dois tempos, gerando subprodutos com a função de serem “os emissários ou mensageiros” das ações que ele irá provocar em cada sistema, órgão, célula ou estrutura. Chamamos estes subprodutos de ozonídeos ou ozonóides. Eles irão promover um estresse oxidativo, controlado e transitório, e que irá gerar uma resposta, uma ativação do sistema antioxidante, de maneira adequada e, ainda, tem efeito progressivo e cumulativo.
Os organismos aeróbicos, devido aos processos metabólicos, apresentam a formação de espécies reativas de oxigênio (EROs) e de nitrogênio (ERNs), podendo acarretar em ESTRESSE OXIDATIVO sendo este um dos principais responsáveis pelos processos de envelhecimento, mutação e morte celular, e por doenças como diabetes, mal de Parkinson, aterosclerose e câncer.
O estresse oxidativo gera também substâncias que são chamadas de produtos da oxidação lipídica (LOPs).
Resumindo:
Em uma reação inicial, os ozonóides atuam nos EROS e ERNs que são potencialmente citotóxicos mas tem meia vida extremamente curta.
São os responsáveis pelas ações imediatas. Início em nanosegundos. Vida média muito curta = 1/2 a 1 minuto.
Atuam diretamente ou tem como alvo os GV, GB e plaquetas. Com essa atuação há uma melhoria de O2 no GV, melhoria da resposta imunológica no GB e uma estimulação da liberação do FP (fator plaquetário) nas plaquetas
Em uma reação tardia, atua nos POL ou LPOs – São responsáveis pelas ações tardias. Início em 4,2 minutos +/- 1,7 (in vivo) Vida média de 10 a 20 minutos (In Vitro pode chegar a mais de 2 horas) e que tem como foco ENDOTÉLIO, MEDULA ÓSSEA e OUTROS ÓRGÃOS. Com essa atuação há uma melhoria da liberação de óxido nítrico no endotélio, liberação de células tronco na medula óssea, (há formação de super – hemácias?) e, em outros órgãos, há uma regulação do stress oxidativo por aumento de produção de enzimas antioxidantes e melhoria intracelular.
É possível explicar e esclarecer como é realizado o processo antioxidativo mas, acredito que não seja o intuito de colocar aqui nesta reposta, coloco, apenas resumido: A formação dos ERO se dá primeiramente pelo o radical superóxido (O2-), que pode ser dismutado em peróxido de hidrogênio (H2O2) ou mesmo através de ação catalítica, pela atuação da enzima superóxido dismutase (SOD). O ESTRESSE OXIDATIVO acontece tanto pelo excesso de RL quanto pela falta de um S A O atuante. PROCESSOS DEGENERATIVOS CRÔNICOS ESTÃO RELAÇIONADOS COM ESTRESSE OXIDATIVO. O Ozônio age no estímulo da ação e da produção do S A O, principalmente do ENZIMÁTICO: SOD + CATALASE + GSHp.
EFEITOS BIOLÓGICOS DO OZÔNIO MEDICINAL
Efeitos Fundamentais = germicida, analgésico e anti-inflamatório.
Glóbulos Vermelhos = aumenta a disponibilidade de O2 nos tecidos.
Melhora a “forma” do glóbulo vermelho.
Leucócitos = modula o sistema imunitário.
Plaquetas = libera fatores de crescimento.
Endotélio = libera os eritrócitos superdotados.
Medula = libera as células tronco.
Outros Órgãos = modula as enzimas antioxidantes.
Efeito bactericida – germicida = se dá pela ação na parede destes micro-organismos, “destruindo” a parede celular.
Efeito sobre o Metabolismo → Ácidos Graxos = melhora o seu metabolismo. Aumenta o uso da glicose a nível celular ; melhora o metabolismo proteico ; sobre os lipídios insaturados = os oxida e induz ao mecanismo de reparação.
fico a disposição.
Quem apresenta G6PD em 4,33 pode se submeter a tratamentos estéticos, por exemplo a criolipolise/CrioExposição?
Minha irma nunca apresentou nenhum sinal e sintoma ao longo dos seus 26 anos. Ela tem resistencia a insulina e voltou a fazer uso da metformina, toma vinho, come normal o que der vontade. So chegou nesse resultado pois iria fazer ozonioterapia, mas esta querendo refazer o exame para tirar as dúvidas e saber tambem se pode fazer criolipolise e/ou CrioExposição
Filipe
Veja, a glicose-6-fosfato desidrogenase (G6PD) é uma enzima que catalisa diversas reações enzimáticas entre elas, manter a glutationa na sua forma reduzida, responsável pela eliminação dos metabólitos oxidativos das células. A dosagem (preciso saber os valores de referência do método utilizado) ao que me “parece” está normal. No caso da sua irmã, me parece que ela deve ter algum disturbio pois a resistência à insulina acontece quando as células do corpo não respondem à ação desse hormônio e têm dificuldade para absorver a glicose do sangue, o que estimula uma produção de mais insulina, aumentando os níveis desse hormônio no sangue.Ela tem acompanhado a glicemia? Ela faria ozonioterapia por que motivo? e a criolipólise? Não estou entendedo o porque desses procedimentos para poder dar opinião…fico a disposição
Olá, estou com muitas dúvidas, fiz o teste do pezinho no meu bebê com 7 dias de vida, demorou 6 meses pra sair o resultado pelo SUS, eu estava comendo tudo normal e ele tomando medicações tbm q não poderiam, o teste deu alteração e refiz e deu alteração novamente, essa alteração pode ter sido pq eu amamento e não fiz dieta esses seis meses ou realmente ele tem G6pd, pode haver a reprodução tardia da enzima até os 2 anos de idade ou ele já tem o diagnóstico de G6pd?
obs: meu bebê de 6 meses nunca teve icterícia, nunca ficou amarelinho hemolizando, tudo normal esse tempo todo sem fazer nenhuma dieta, estou esperançosa para q ele não tenha, pois estou muito preocupada.
Debora
Por que você fez a pesquisa do G6PG no seu bebê?
Qual o motivo de você estar preocupada com essa enzima?
A deficiência da glicose-6-fosfato desidrogenase (G6PD) é um erro inato do metabolismo sim, ou seja, a pessoa nasce com essa deficiência sendo a mais freqüente das enzimopatias conhecidas, afetando cerca de 400 milhões de pessoas em todo mundo porém, não consideramos um parâmetro vital determinante. Principalmente para um bebê.
Apesar de ser um erro inato do metabolismo, ele só realizado caso haja solicitação por alguma suspeita, não fazendo parte dos 14 exames pesquisados de rotina pelo SUS conforme você pode ver neste artigo…http://cmqv.org/erros-inatos-do-metabolismo/
Esse “erro” não é pesquisado visto que a deficiência de G6PD é uma anomalia que geralmente dizemos com consequências mais tardia sendo que muitas pessoas podem passar a vida toda sem saber que possuem essa deficiência. É uma doença genética caracterizada por um defeito na enzima glicose-6-fosfato desidrogenase (G6PD), que é responsável por proteger as células dos danos causados pelos radicais livres e por manter os glóbulos vermelhos saudáveis. A falta ou o funcionamento incorreto dessa enzima pode resultar na destruição dos glóbulos vermelhos, levando ao desenvolvimento da anemia hemolítica.Importante mencionar que deficiência da enzima G6PD por si só não é suficiente para causar a anemia hemolítica, mas alguns fatores como doenças infecciosas ou ingestão de medicamentos, podem desencadear a anemia hemolítica, com sintomas como falta de ar, urina escura ou palpitação. Além disso, o consumo de favas em pessoas com essa deficiência pode levar ao desenvolvimento da anemia hemolítica grave, também chamada de favismo.
Apenas esclarecendo e explicando de forma bem simples, quando vamos realizar procedimentos que consideramos “oxidativos” e, portanto, produzem radicais livres mesmo que momentâneos como o caso da Ozonioterapia, realizamos a pesquisa dessa enzima pois, na falta dela, não podemos induzir mais stress oxidativo mesmo que temporário pois a ativação da eliminação desses radicais estarão prejudicadas.
Está havendo alguma alteração em seu bebe que te levou a essa suspeita?
Aguardo seu retorno, estou à disposição para ajudar, caso precise
Ol,a obrigada por responder, então eu fiz o teste de pezinho no SUS e deu uma alteração e eles pediram pra repetir e deu alteração novamente, fiz agora com 6 meses, e estou amamentando e estava comendo tudo normal e mediquei ele com remédios q não podiam e ele nunca teve nenhum sintomas de nada, meu desespero foi tanto q resolvi pesquisar sobre G6pd pra poder entender um pouco, passei por uma pediatra e ela já deu diagnóstico de G6pd, eu ainda perguntei se não tinha q aguarda pra fazer novamente o exame pq li q pode haver a reprodução tardia dessa enzima se não for genético.
Agradeço todo conteúdo mantido nesse artigo, são informações claras, objetivas e simples compreensão.
Ingrid
Agradeço MUITO seu comentário e fico à disposição
abraços
quem tem o g6pd pode fazer apiterapia?
Eliza
A G6PD É MUITO IMPORTANTE! MARAVILHA QUE VOCÊ TENHA ESSA ENZIMA !!!
AH!….e a APITERAPIA TAMBÉM É MUITO BOA!
VEJA:
A glicose-6-fosfato desidrogenase (G6PD) é uma enzima que faz parte da produção de energia. A falta de G6PG, em situações específicas, pode levar à oxidação e destruição de células do corpo. Isso pode ocorrer em todas as células, mas as mais afetadas geralmente são as vermelhas do sangue (hemácias). Ela é uma enzima que catalisa diversas reações enzimáticas entre elas, manter a glutationa na sua forma reduzida, responsável pela eliminação dos metabólitos oxidativos das células.
De uma forma geral, dizemos que quem tem a G6PG normal, já tem um grande passo rumo a restauração de seus processos oxidativos…NOTA: A deficiência de G6PD é uma doença genética de herança recessiva ligada ao cromossomo X, apesar de afetar predominantemente os homens, as mulheres heterozigotas podem apresentar crises hemolíticas. A maioria dos pacientes é assintomático por isso nosso controle rigoroso do paciente antes de fazer, por exemplo, OZONIOTERAPIA, que é um processo com base oxidativa…
Quanto a fazer APITERAPIA, que é uma das PICs fabulosas, quem tem a G6PD normal, não terá por esse parâmetro, motivo de não realizar essa terapia, salvo outro problema que possa impedir esse tipo de terapia….Estamos montando um portal com todas as práticas integrativas mas, no momento, apenas a APITERAPIA está quase completa. Se quiser saber um pouco, entre neste link – https://cmqv.org/apiterapia/
abraços